مقدمه
شیمی علمی است که تغییرات مواد و واکنشهای آنها را مطالعه میکند. هر واکنش شیمیایی شامل شکستن پیوندهای شیمیایی در واکنشدهندهها و تشکیل پیوندهای جدید در محصولات است. اما در طی این تغییرات، مقدار کل جرم قبل و بعد از واکنش یکسان باقی میماند. این ویژگی اساسی به قانون پایستگی جرم مشهور است و در تنظیم معادلات شیمیایی و درک فرآیندهای صنعتی و زیستی اهمیت فراوانی دارد.
مفهوم واکنشهای شیمیایی
یک واکنش شیمیایی را میتوان به صورت کلی به شکل زیر نمایش داد:
واکنشدهندهها → محصولات
در این فرآیند، ساختار مواد تغییر میکند، اما نوع و تعداد اتمهای موجود در سیستم ثابت باقی میماند.
انواع واکنشهای شیمیایی
واکنشهای شیمیایی به چند دسته اصلی تقسیم میشوند:
- واکنشهای ترکیبی (سنتز): دو یا چند ماده با هم ترکیب شده و یک ماده جدید را تشکیل میدهند. مثال:2H₂ + O₂ → 2H₂O
- واکنشهای تجزیهای: یک ترکیب به مواد سادهتر تجزیه میشود. مثال:2H₂O₂ → 2H₂O + O₂
- واکنشهای جابهجایی یگانه: یک عنصر جایگزین عنصر دیگر در یک ترکیب میشود. مثال:Zn + CuSO₄ → ZnSO₄ + Cu
- واکنشهای جابهجایی دوگانه: دو ترکیب با هم واکنش داده و اجزای آنها جابهجا میشوند. مثال:NaCl + AgNO₃ → NaNO₃ + AgCl
- واکنشهای احتراقی: ترکیبات آلی در حضور اکسیژن سوخته و دیاکسید کربن و آب تولید میکنند. مثال:CH₄ + 2O₂ → CO₂ + 2H₂O
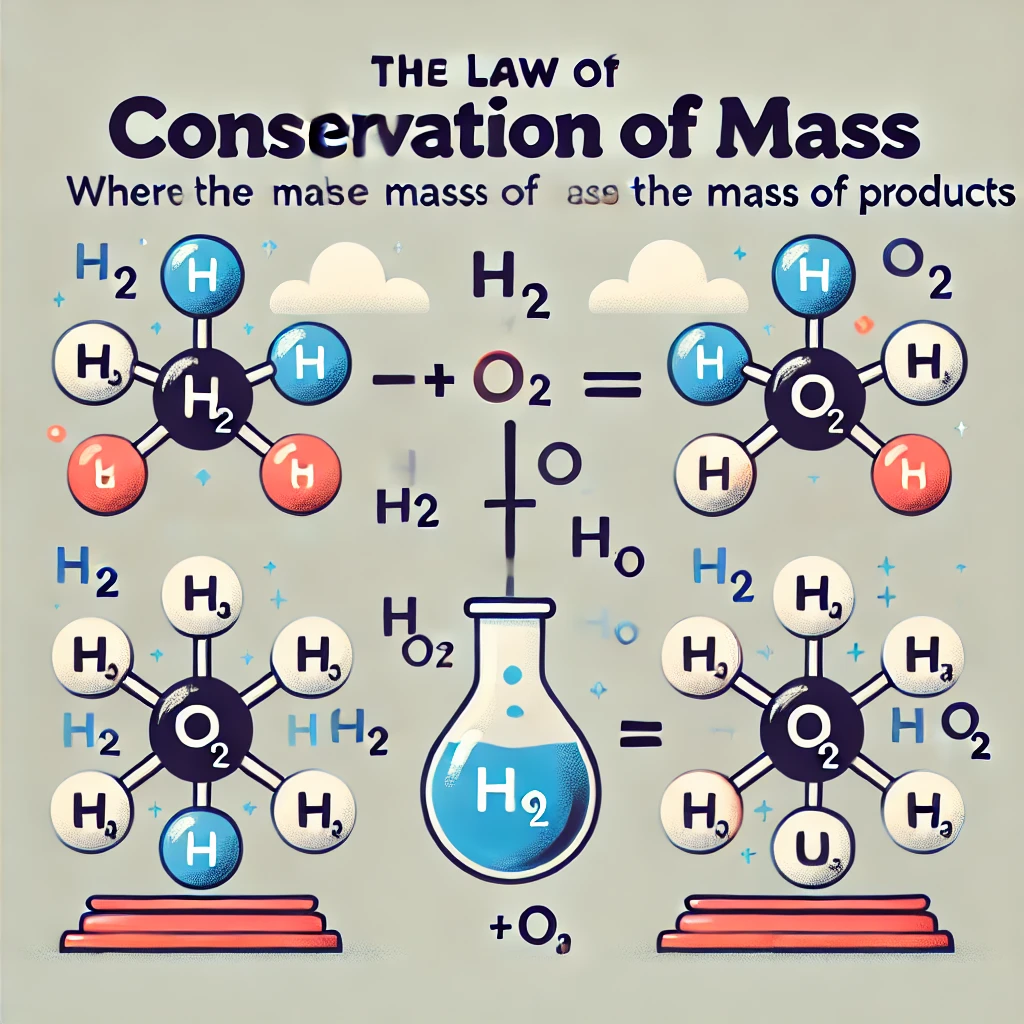
قانون پایستگی جرم و اهمیت آن
قانون پایستگی جرم بیان میکند که در یک واکنش شیمیایی، مجموع جرم واکنشدهندهها با مجموع جرم محصولات برابر است. این قانون را میتوان به صورت ریاضی به شکل زیر نوشت:
جرم کل واکنشدهندهها = جرم کل محصولات
این اصل در موارد زیر اهمیت زیادی دارد:
- موازنه معادلات شیمیایی: هر معادله شیمیایی باید متعادل باشد تا نشان دهد که جرم قبل و بعد از واکنش تغییر نکرده است.
- محاسبات استوکیومتری: در صنایع شیمیایی و داروسازی، محاسبه دقیق مقدار مواد اولیه و محصولات بر اساس این قانون انجام میشود.
- فرآیندهای زیستی: متابولیسم و سایر واکنشهای زیستی نیز از این اصل تبعیت میکنند.
مثال از قانون پایستگی جرم
به عنوان مثال، در واکنش تجزیه آب:
2H₂O → 2H₂ + O₂
جرم کل آب قبل از واکنش برابر با مجموع جرم هیدروژن و اکسیژن تولید شده است. اگر ۱۸ گرم آب وارد واکنش شود، ۲ گرم هیدروژن و ۱۶ گرم اکسیژن به دست خواهد آمد.
نتیجهگیری
واکنشهای شیمیایی اساس تغییرات مواد در طبیعت و صنعت هستند. قانون پایستگی جرم یکی از مهمترین اصول در شیمی است که به ما امکان میدهد معادلات شیمیایی را موازنه کنیم، میزان مواد مصرفی و تولیدی را محاسبه کنیم و درک بهتری از فرآیندهای شیمیایی داشته باشیم. شناخت این قانون برای دانشجویان، محققان و صنایع شیمیایی ضروری است.