الکتروشیمی چیست؟
الکتروشیمی (Electrochemistry) علمی است که به مطالعه واکنشهای شیمیایی همراه با انتقال الکترون میپردازد. در این شاخه از شیمی، تبدیل انرژی شیمیایی به الکتریکی و بالعکس بررسی میشود. واکنشهای الکتروشیمیایی اغلب در محلولهای آبی و در حضور الکترودها رخ میدهند.
مفاهیم پایه در الکتروشیمی
برای درک بهتر الکتروشیمی، آشنایی با مفاهیم زیر ضروری است:
1. الکترود
الکترود سطحی فلزی یا نیمهرسانا است که در آن واکنشهای اکسایش یا کاهش رخ میدهد. هر سلول الکتروشیمیایی دو الکترود دارد: آند و کاتد.
2. آند و کاتد
- آند: الکترودی که در آن اکسایش صورت میگیرد (از دست دادن الکترون).
- کاتد: الکترودی که در آن کاهش صورت میگیرد (دریافت الکترون).
3. الکترولیت
محلولی است که یونهای آزاد دارد و میتواند جریان الکتریکی را هدایت کند. وجود الکترولیت برای بسته شدن مدار الکتریکی در سلولهای الکتروشیمیایی ضروری است.
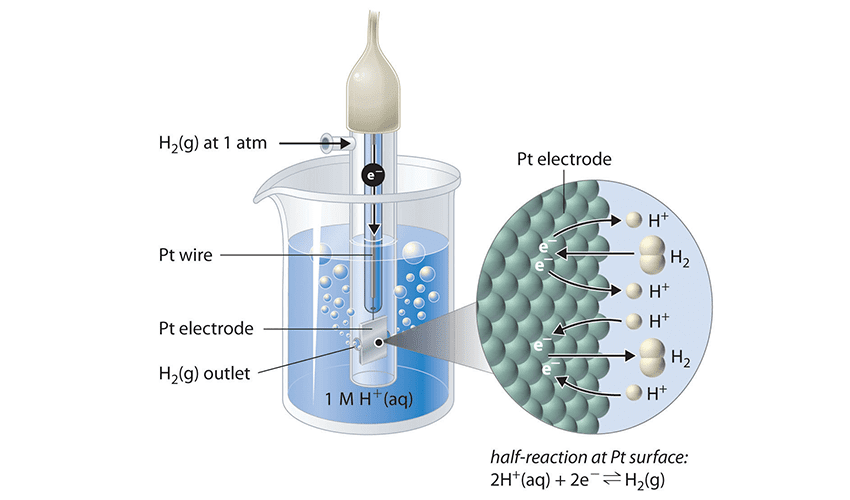
4. پتانسیل الکترودی
توانایی یک الکترود در انجام واکنش اکسایش یا کاهش نسبت به الکترود استاندارد هیدروژن (SHE) با ولتاژ صفر اندازهگیری میشود.
انواع سلولهای الکتروشیمیایی
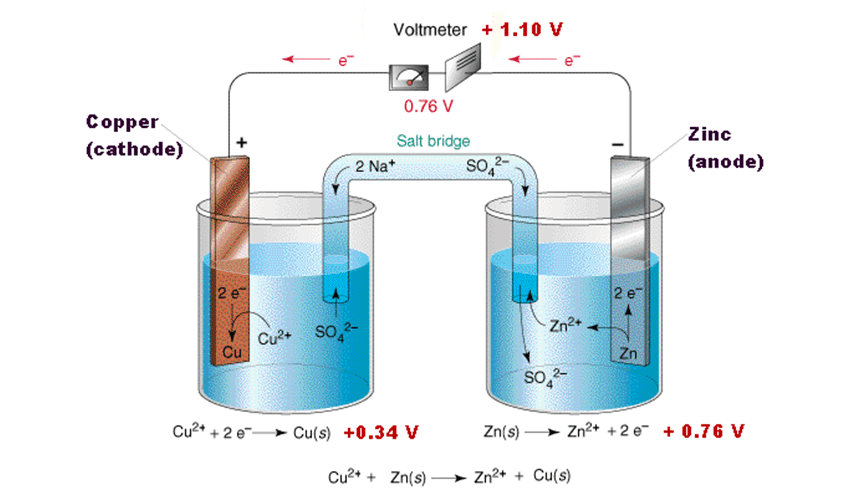
1. سلول گالوانی (ولتایی)
در این نوع سلول، واکنش شیمیایی خودبهخودی انجام شده و انرژی شیمیایی را به انرژی الکتریکی تبدیل میکند. مثال رایج آن باتریها هستند.
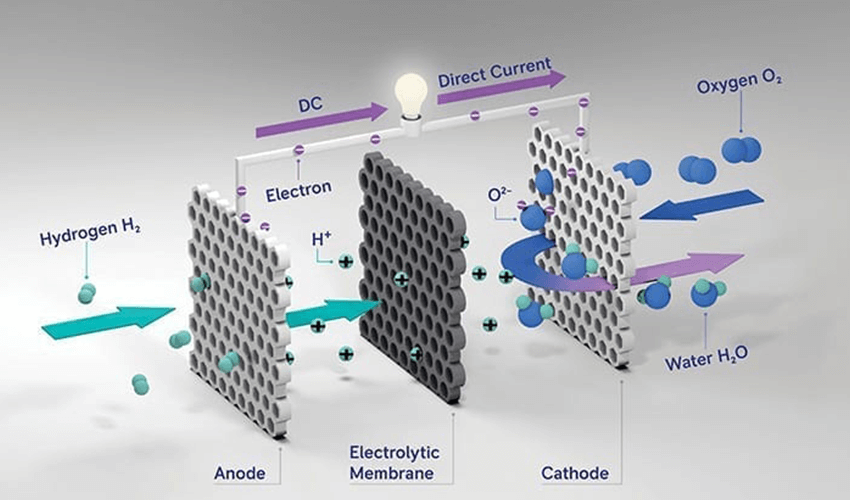
2. سلول الکترولیتی
در این سلول، با استفاده از انرژی الکتریکی واکنش شیمیایی غیرخودبهخودی انجام میشود؛ مانند فرآیند آبکافت یا آبکاری فلزات.
مثالهایی از واکنشهای الکتروشیمیایی
واکنش در سلول گالوانی (باتری روی-مس):
⁻Zn(s) → Zn²⁺(aq) + 2e (آند)
Cu²⁺(aq) + 2e⁻ → Cu(s) (کاتد)
واکنش در سلول الکترولیز آب:
2H₂O(l) → 2H₂(g) + O₂(g) (با عبور جریان الکتریکی)
کاربردهای الکتروشیمی
الکتروشیمی در زندگی روزمره و صنایع نقش پررنگی دارد:
- ساخت باتریها و پیلهای سوختی
- آبکاری فلزات مانند طلا، نقره، کروم
- تولید گازهای صنعتی مانند هیدروژن و اکسیژن
- حسگرهای شیمیایی (مثلاً حسگر گلوکز)
- تصفیه آب و پساب با روشهای الکترولیتی
جمعبندی
الکتروشیمی علمی کاربردی و گسترده است که پایه و اساس بسیاری از فناوریهای نوین مانند باتریهای لیتیومی، پیلهای سوختی و فرآیندهای صنعتی را تشکیل میدهد. شناخت اصول این علم، گامی مهم در درک بهتر انرژی و شیمی مدرن است.