واکنشهای اکسایش کاهش چیستند؟
واکنشهای اکسایش-کاهش (Redox) واکنشهایی هستند که در آنها انتقال الکترون از یک ماده به ماده دیگر رخ میدهد. این نوع واکنشها نقش کلیدی در بسیاری از فرآیندهای زیستی، صنعتی و الکتروشیمیایی دارند.
تعریف اکسایش و کاهش
● اکسایش (Oxidation):
فرآیندی که در آن یک ماده الکترون از دست میدهد.
مثال:
⁻Zn → Zn²⁺ + 2e
فلز روی در این واکنش اکسایش یافته است.
● کاهش (Reduction):
فرآیندی که در آن یک ماده الکترون دریافت میکند.
مثال:
Cu²⁺ + 2e⁻ → Cu
یون مس در این واکنش کاهش یافته است.
اکسنده و کاهنده
● اکسنده (Oxidizing Agent):
مادهای که خودش کاهش مییابد و باعث اکسایش ماده دیگر میشود.
در مثال بالا، ⁺Cu² اکسنده است چون الکترون گرفته و کاهش یافته است.
● کاهنده (Reducing Agent):
مادهای که خودش اکسایش مییابد و باعث کاهش ماده دیگر میشود.
در همان مثال، Zn کاهنده است چون الکترون داده و اکسایش یافته است.
نیمواکنشها (Half-Reactions)
در واکنشهای Redox، کل واکنش را میتوان به دو نیمواکنش تقسیم کرد: یکی برای اکسایش و دیگری برای کاهش.
نیمواکنش اکسایش (فلز روی):
⁻Zn → Zn²⁺ + 2e
نیمواکنش کاهش (یون مس):
Cu²⁺ + 2e⁻ → Cu
جمع این دو نیمواکنش، واکنش کلی زیر را تشکیل میدهد:
واکنش فلز روی با یونهای مس
هنگامی که فلز روی (Zn) را در محلول دارای یونهای Cu²⁺ قرار دهیم، واکنش زیر رخ میدهد:
Zn(s) + Cu²⁺(aq) → Zn²⁺(aq) + Cu(s)
تحلیل واکنش:
- روی (Zn) الکترون از دست میدهد و به +Zn² تبدیل میشود → اکسایش
- یون مس (+Cu²) الکترون میگیرد و به مس فلزی (Cu) تبدیل میشود → کاهش
- روی: عامل کاهنده
- یون مس: عامل اکسنده
این واکنش نمونهای ساده و مهم از یک واکنش اکسایش کاهش است که در بسیاری از آزمایشگاههای آموزشی نیز مشاهده میشود. رسوب مس به صورت فلزی روی سطح روی دیده میشود.
کاربرد واکنشهای اکسایش کاهش
- تنفس سلولی و فتوسنتز
- ساخت باتریها (مثل باتری روی-کربن یا لیتیوم-یون)
- پالایش فلزات
- تصفیه آب (با استفاده از عوامل اکسنده)
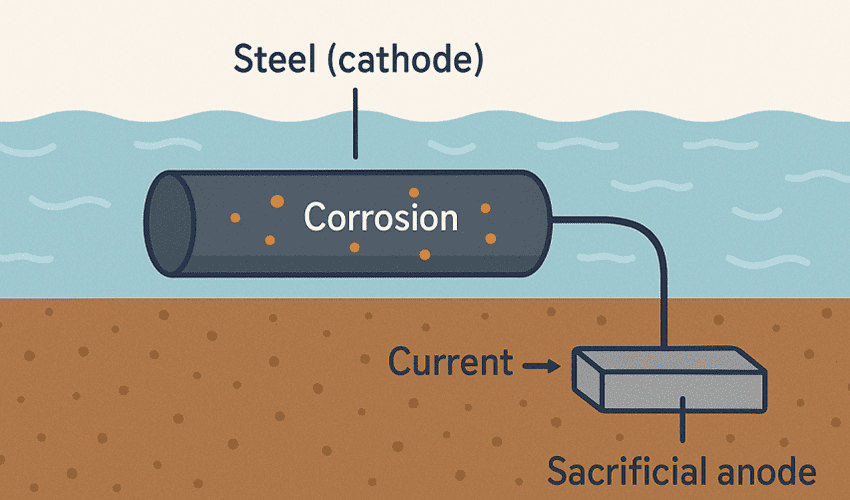
- آبکاری فلزات و محافظت از خوردگی
جمعبندی
در واکنشهای اکسایش کاهش، انتقال الکترون اساس واکنش است. شناخت مفاهیم اکسایش، کاهش، اکسنده، کاهنده و نحوه نوشتن نیمواکنشها، پایه درک شیمی الکتروشیمیایی و زیستی است. واکنش فلز روی با یونهای مس، نمونهای ساده و قابل مشاهده از این نوع واکنشها است که درک عملی آن را آسان میکند.