مقدمه
در بسیاری از واکنشهای شیمیایی، محصولات تولید شده ممکن است دوباره به واکنشدهندهها تبدیل شوند. به این دسته از واکنشها، واکنشهای برگشتپذیر گفته میشود. در مقابل، واکنشهایی نیز وجود دارند که به طور کامل به سمت تولید فرآورده پیش میروند و به عقب باز نمیگردند که به آنها واکنشهای برگشتناپذیر گفته میشود. شناخت این دو نوع واکنش و مفهوم **سامانه تعادلی** برای تحلیل واکنشها و طراحی فرآیندهای شیمیایی بسیار مهم است.
واکنش برگشتپذیر چیست؟
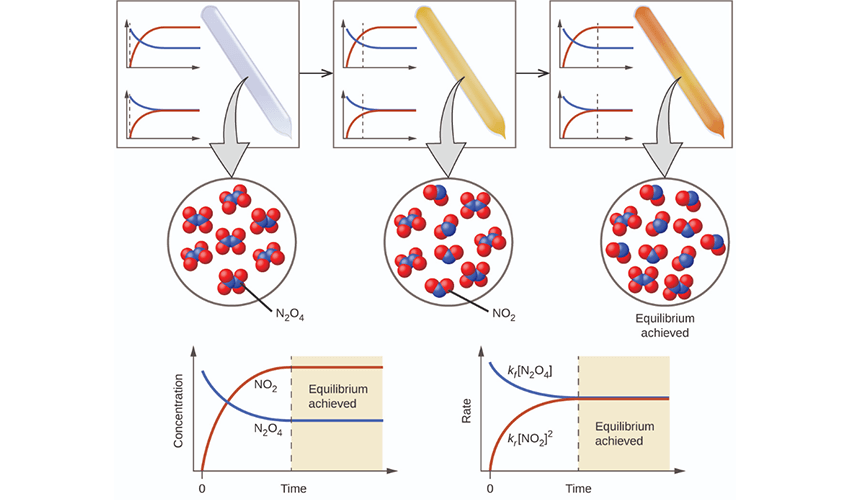
واکنش برگشتپذیر، واکنشی است که در آن، محصولات میتوانند دوباره به واکنشدهندهها تبدیل شوند. این واکنشها در دو جهت رفت و برگشت اتفاق میافتند و در یک زمان مشخص به حالت **تعادل شیمیایی** میرسند.
نمونه واکنش برگشتپذیر:
N₂ + 3H₂ ⇌ 2NH₃
در این واکنش تولید آمونیاک (NH₃) با مصرف نیتروژن و هیدروژن همراه است، اما همزمان آمونیاک نیز میتواند تجزیه شده و دوباره نیتروژن و هیدروژن تولید کند.
واکنش برگشتناپذیر چیست؟
در واکنشهای برگشتناپذیر، واکنشدهندهها پس از واکنش بهطور کامل به محصولات تبدیل میشوند و واکنش در جهت برگشت عملاً اتفاق نمیافتد یا بسیار ناچیز است.
مثال:
Mg + 2HCl → MgCl₂ + H₂
در این واکنش، منیزیم با اسید کلریدریک واکنش داده و گاز هیدروژن تولید میشود، اما گاز هیدروژن مجدداً به منیزیم تبدیل نمیشود.
سامانه تعادلی چیست؟
سامانه تعادلی به سامانهای گفته میشود که در آن، سرعت واکنش رفت و برگشت برابر است و غلظت واکنشدهندهها و محصولات در طول زمان ثابت باقی میماند.
ویژگیهای سامانه تعادلی:
واکنش در یک ظرف بسته انجام میشود
غلظت مواد تغییر نمیکند، اما واکنش ادامه دارد (تعادل پویا)
واکنش به هر دو جهت ادامه دارد، اما نرخ رفت = نرخ برگشت
نمودار تعادل واکنش برگشتپذیر
اگر نمودار غلظت واکنشدهنده و فرآورده را در طول زمان رسم کنیم، در ابتدا غلظت فرآوردهها افزایش و واکنشدهندهها کاهش مییابد، اما پس از مدتی به مقدار ثابتی میرسند که نشاندهنده تعادل است.
تفاوت اصلی واکنشهای برگشتپذیر و برگشتناپذیر
| ویژگی | برگشتپذیر | برگشتناپذیر |
|---|---|---|
| قابلیت برگشت | دارد | ندارد |
| تعادل | برقرار میشود | برقرار نمیشود |
| نماد واکنش | ⇌ | → |
| مثال | NH₃ ⇌ N₂ + 3H₂ | Mg + HCl → H₂ + MgCl₂ |
اهمیت شناخت واکنشهای برگشتپذیر و سامانه تعادلی
در طراحی راکتورهای شیمیایی
در سنتز صنعتی مواد شیمیایی (مانند آمونیاک در فرآیند هابر)
در بیوشیمی و تنظیم فرآیندهای زیستی
در کنترل شرایط آزمایشگاهی برای افزایش بازده واکنش
جمعبندی
شناخت تفاوت واکنشهای برگشتپذیر و برگشتناپذیر و درک مفهوم سامانه تعادلی، از مباحث پایه اما مهم شیمی عمومی است. این مفاهیم نهتنها در آزمونهای علمی بلکه در صنایع مختلف، پزشکی و محیطزیست نیز کاربرد فراوانی دارند.