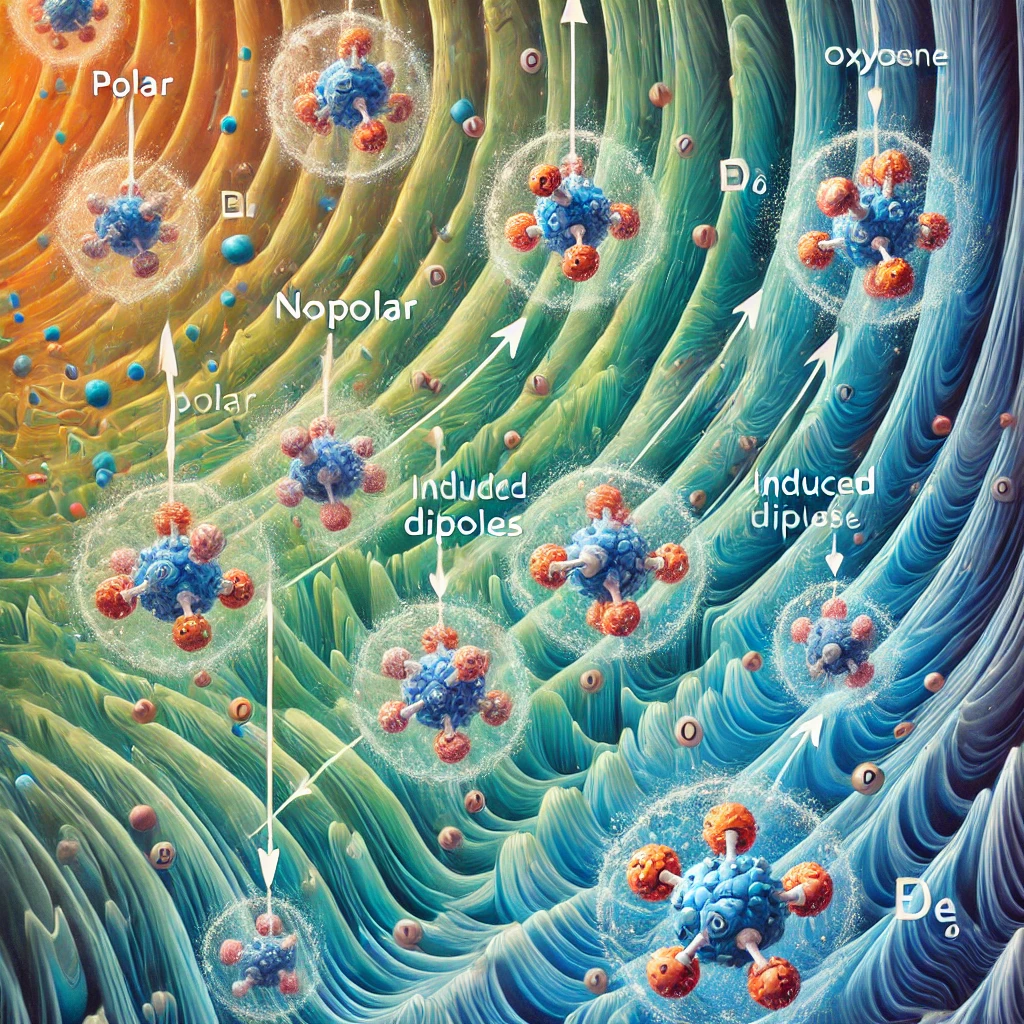
مقدمه
میدان الکتریکی تأثیرات مهمی بر رفتار مولکولها دارد. برخی از مولکولها به دلیل توزیع نامتقارن بارهای الکتریکی، در حضور میدان خارجی واکنش نشان میدهند، درحالیکه برخی دیگر تحت تأثیر قرار نمیگیرند. شناخت این رفتارها نقش مهمی در درک پدیدههای فیزیکی، شیمیایی و زیستی دارد. در این مقاله، مفاهیم مولکولهای قطبی، ناقطبی و دوقطبی بررسی شده و تأثیر میدان الکتریکی بر آنها توضیح داده میشود.
مفاهیم پایه: قطبیت مولکولها
۱. مولکولهای قطبی
مولکولهای قطبی به مولکولهایی گفته میشود که در آنها توزیع بار الکتریکی نامتقارن است، یعنی یک سمت مولکول دارای بار جزئی مثبت و سمت دیگر دارای بار جزئی منفی است. این پدیده ناشی از تفاوت در الکترونگاتیوی اتمهای تشکیلدهنده مولکول است.
مثالها:
- آب (H₂O): اکسیژن الکترونگاتیوتر از هیدروژن است، بنابراین یک سر مولکول دارای بار جزئی منفی (اکسیژن) و سر دیگر دارای بار جزئی مثبت (هیدروژنها) میشود.
- آمونیاک (NH₃): نیتروژن الکترونگاتیوتر از هیدروژن است و باعث قطبیت مولکول میشود.
۲. مولکولهای ناقطبی
در این مولکولها، توزیع بار به طور یکنواخت است و هیچ قطب مشخصی در آنها وجود ندارد. این نوع مولکولها یا دارای پیوندهای کاملاً کووالانسی هستند یا به شکلی متقارن قرار گرفتهاند که اثر قطبیت خنثی میشود.
مثالها:
- گازهای نجیب (He, Ne, Ar) که به طور طبیعی ناقطبی هستند.
- مولکولهایی مانند O₂، N₂ و CH₄ (متان) که ساختار متقارن دارند.
۳. مولکولهای دوقطبی القایی
برخی مولکولهای ناقطبی در حضور میدان الکتریکی میتوانند قطبیت موقتی پیدا کنند. در این حالت، الکترونهای آنها تحت تأثیر میدان خارجی تغییر آرایش داده و یک دوقطبی القایی ایجاد میشود.
🔹 مثالها:
- مولکول ید (I₂): در حالت عادی ناقطبی است، اما در میدان الکتریکی دوقطبی القایی ایجاد میکند.
- گازهای نیتروژن و اکسیژن در حضور میدان قوی میتوانند به دوقطبیهای موقت تبدیل شوند.
اثر میدان الکتریکی بر مولکولها
۱. رفتار مولکولهای قطبی در میدان الکتریکی
مولکولهای قطبی مانند آب، زمانی که در یک میدان الکتریکی قرار میگیرند، به سمت قطب مخالف میدان جهتگیری میکنند. به این فرآیند جهتگیری دوقطبیها (dipole alignment) گفته میشود.
توضیح فیزیکی:
- در یک میدان الکتریکی خارجی، سر مثبت مولکول به سمت قطب منفی میدان کشیده میشود و سر منفی به سمت قطب مثبت میدان میچرخد.
- اگر شدت میدان الکتریکی افزایش یابد، نظم بیشتری در آرایش مولکولها ایجاد میشود.
کاربردهای این ویژگی:
- در خازنهای الکتریکی، حضور دیالکتریکهایی مانند آب، باعث افزایش ظرفیت ذخیره بار میشود.
- در فرایندهای الکتروفورز برای جداسازی مولکولهای زیستی مانند پروتئینها.
۲. رفتار مولکولهای ناقطبی در میدان الکتریکی
مولکولهای ناقطبی در غیاب میدان الکتریکی دارای بار توزیعشده یکنواختی هستند. اما در حضور میدان قوی، امکان دارد که یک دوقطبی القایی در آنها شکل بگیرد، به این معنا که الکترونها به سمت قطب مثبت میدان کشیده میشوند و یک سر مولکول موقتاً دارای بار جزئی مثبت و سر دیگر دارای بار جزئی منفی میشود.
توضیح فیزیکی:
- شدت این اثر به قابلیت قطبشپذیری مولکول بستگی دارد.
- مولکولهایی با الکترونهای والانس بیشتر (مانند ید، گوگرد) به راحتی قطبش پیدا میکنند.
کاربردهای این ویژگی:
- در جداسازی مولکولها با میدان الکتریکی در تکنیکهای صنعتی.
- در مواد دیالکتریک خاص که برای عایقبندی الکتریکی استفاده میشوند.
مثالهایی از رفتار مولکولها در میدان الکتریکی
| نوع مولکول | مثال | رفتار در میدان الکتریکی |
|---|---|---|
| قطبی | آب (H₂O)، آمونیاک (NH₃) | جهتگیری به سمت قطبهای میدان |
| ناقطبی | O₂، N₂، CH₄ | عدم تأثیر یا القای دوقطبی ضعیف |
| دوقطبی القایی | I₂، CO₂ | ایجاد دوقطبی موقت در میدان قوی |
نتیجهگیری
مولکولها بسته به ساختار الکترونی و قطبیت خود، در میدان الکتریکی رفتارهای متفاوتی دارند. مولکولهای قطبی مانند آب به دلیل عدم تقارن بارها، در حضور میدان الکتریکی آرایش مشخصی پیدا میکنند. در مقابل، مولکولهای ناقطبی معمولاً تحت تأثیر قرار نمیگیرند، مگر آنکه میدان قوی باعث القای قطبیت شود. این ویژگیها در بسیاری از فناوریها و فرایندهای صنعتی، از جمله طراحی مواد دیالکتریک، الکتروفورز، و سیستمهای ذخیرهسازی انرژی نقش حیاتی دارند.