رسانایی الکتریکی محلولها و قدرت اسیدی: نقش یونها در انتقال جریان الکتریسیته
مقدمه
رسانایی الکتریکی محلولها یکی از مفاهیم کلیدی در شیمی فیزیک و شیمی تحلیلی است. وقتی یک ماده در آب حل میشود، اگر به یون تجزیه گردد، میتواند جریان الکتریسیته را از خود عبور دهد. این خاصیت به رسانایی یونی معروف است و اساس درک ما از عملکرد اسیدها، بازها و نمکها در محلولهای آبی را تشکیل میدهد.
رسانایی الکتریکی: دو نوع اصلی
1. رسانایی الکترونی:
معمولاً در فلزات و جامدات اتفاق میافتد.
حاملهای بار، الکترونها هستند.
مثال: رسانایی در سیم مسی
2. رسانایی یونی:
مخصوص محلولهای آبی و مذابهای یونی است.
حاملهای بار، یونها هستند.
مثال: رسانایی در محلول NaCl
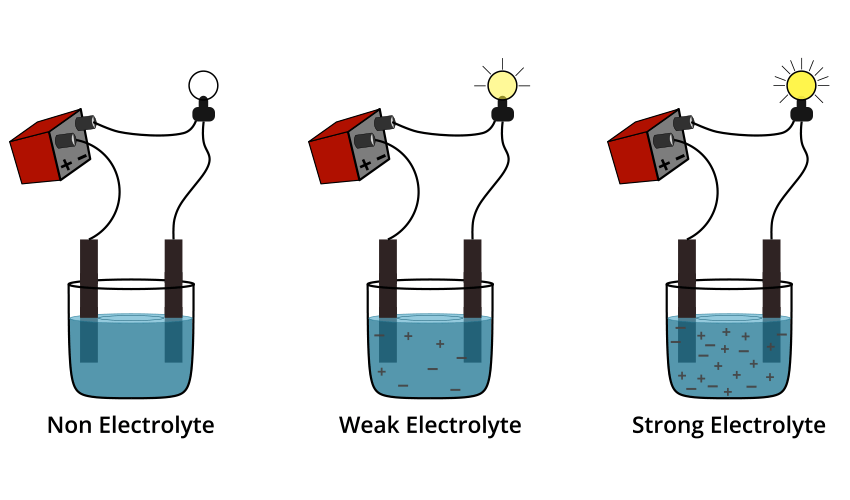
الکترولیت چیست؟
الکترولیت: مادهای است که در آب حل میشود و به یونها تجزیه میشود و باعث رسانایی محلول میگردد.
بهطور کلی:
الکترولیت قوی → تفکیک کامل → رسانایی بالا
الکترولیت ضعیف → تفکیک جزئی → رسانایی پایین
مثالها:
⁻NaCl → Na⁺ + Cl (الکترولیت قوی)
⁺CH₃COOH ⇌ CH₃COO⁻ + H (الکترولیت ضعیف)
محلول الکترولیت
محلولی است که در آن الکترولیت حل شده و یونهای آزاد دارد. این یونها هستند که باعث انتقال جریان الکتریکی در محلول میشوند. قدرت رسانایی این محلول به موارد زیر وابسته است:
نوع الکترولیت (قوی یا ضعیف)
غلظت یونها
دما
میزان تحرک یونها
قدرت اسیدی و رسانایی
اسید قوی:
بهطور کامل در آب یونیزه میشود.
یونهای H₃O⁺ زیادی تولید میکند.
رسانایی بالا دارد.
مثال:
⁻HCl + H₂O → H₃O⁺ + Cl
اسید ضعیف:
بهصورت جزئی در آب یونیزه میشود.
مقدار کمی ⁺H₃O تولید میکند.
رسانایی پایین دارد.
مثال:
⁺CH₃COOH + H₂O ⇌ CH₃COO⁻ + H₃O
نکته مهم: تفاوت در رسانایی محلولهای اسیدی، معیار مناسبی برای سنجش قدرت اسیدی است.
آزمایش ساده مقایسه رسانایی
در آزمایشگاه، میتوان با استفاده از پیاچمتر و رساناسنج دو اسید با غلظت برابر را بررسی کرد:
| محلول | نوع اسید | رسانایی نسبی | pH |
|---|---|---|---|
| HCl (1M) | قوی | بسیار زیاد | ≈ 0 |
| CH₃COOH (1M) | ضعیف | کمتر | ≈ 3 |
نتیجهگیری
رسانایی الکتریکی محلولها مستقیماً به حضور یونها مرتبط است. اسیدهای قوی با تفکیک کامل، رسانایی بالا ایجاد میکنند، در حالی که اسیدهای ضعیف رسانایی کمتری دارند. درک تفاوت رسانایی یونی و الکترونی و شناخت الکترولیتها، کلید فهم بسیاری از مفاهیم مهم در شیمی است.