مقدمه
در علم شیمی، درک رفتار اسیدها و بازها و تحلیل واکنشهای تعادلی، نیازمند آشنایی با مفاهیمی مانند ثابت تعادل (K)، ثابت یونش اسید (Ka) و ثابت یونش باز (Kb) است. این مفاهیم پایهای، هم در مسائل نظری و هم در کاربردهای عملی مثل طراحی دارو و صنایع شیمیایی نقش مهمی دارند.
ثابت تعادل چیست؟
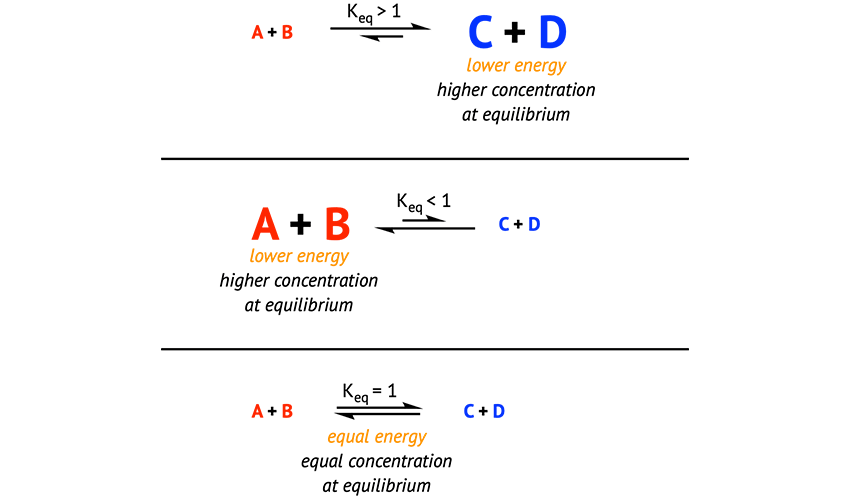
ثابت تعادل (K) عددی است که نسبت غلظت مواد فرآورده به واکنشدهندهها را در شرایط تعادل نشان میدهد.
اگر واکنش بهصورت زیر باشد:
aA + bB ⇌ cC + dD
فرمول ثابت تعادل به صورت زیر است:
K = ([C]^c × [D]^d) / ([A]^a × [B]^b)
مقدار K بزرگ یعنی واکنش به سمت محصولات (راست) میل دارد. مقدار K کوچک یعنی واکنشدهندهها باقی ماندهاند.
ثابت یونش اسید (Ka) چیست؟
ثابت یونش اسید، معیاری برای قدرت یک اسید است. هر چه مقدار Ka بزرگتر باشد، اسید قویتر است.
مثال:
⁻HA ⇌ H⁺ + A
فرمول Ka:
Ka = ([H⁺] × [A⁻]) / [HA]
ثابت یونش باز (Kb) چیست؟
مشابه Ka، برای بازها نیز Kb تعریف میشود.
مثال:
⁻B + H₂O ⇌ BH⁺ + OH
فرمول Kb:
Kb = ([BH⁺] × [OH⁻]) / [B]
مقدار Kb بزرگ نشاندهنده باز قوی است.
ارتباط بین Ka، Kb و Kw
بین یک اسید و باز مزدوج، رابطه زیر برقرار است:
Ka × Kb = Kw
در دمای ۲۵ درجه سانتیگراد، مقدار Kw برابر است با:
1.0 × 10⁻¹⁴
قدرت اسیدی و مفهوم pKa
برای مقایسه قدرت اسیدها از لگاریتم منفی Ka استفاده میکنیم:
pKa = -log(Ka)
هر چه مقدار pKa کمتر باشد، اسید قویتر است.
مثال:
HCl → pKa حدود -7 (اسید بسیار قوی)
CH₃COOH → pKa حدود 4.76 (اسید ضعیف)
کاربردهای ثابت یونش در زندگی و شیمی
تعیین pH محلولها
طراحی داروها با pKa مناسب
تعیین شرایط مناسب برای انجام واکنشهای شیمیایی
تحلیل محیط زیست و واکنشهای زیستی
جمعبندی
مفاهیم ثابت تعادل، Ka، Kb و pKa از پایههای علم شیمی هستند. با درک این مفاهیم میتوان واکنشهای اسید-باز را پیشبینی و کنترل کرد. این مفاهیم در شیمی آلی، تجزیه، زیستی و حتی مهندسی شیمی کاربرد فراوان دارند.