مقدمه
آلومینیوم یکی از پرکاربردترین فلزات در جهان است، اما به علت واکنشپذیری بالا به صورت آزاد در طبیعت یافت نمیشود. این فلز از سنگ معدنی بوکسیت استخراج میشود و اصلیترین روش صنعتی برای تولید آن، فرایند هال (Hall Process) نام دارد.
بوکسیت و آلومینا
ماده اولیه برای تولید آلومینیوم، بوکسیت (سنگ معدن آلومینیوم) است که حاوی مقدار زیادی آلومینا (Al₂O₃) میباشد. در ابتدا با روش بایر (Bayer Process)، آلومینا از بوکسیت استخراج میشود. سپس با فرایند هال، آلومینا به آلومینیوم فلزی تبدیل میشود.
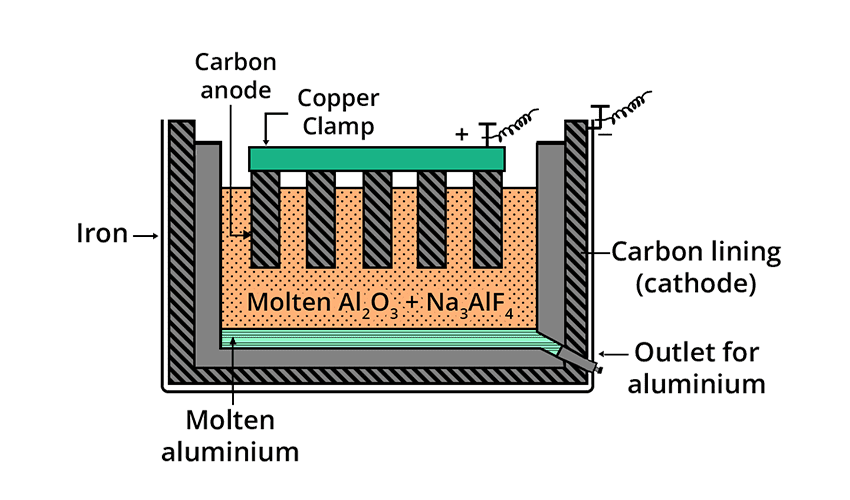
شرح فرایند هال
در این فرآیند:
- آلومینا در کریولیت مذاب (Na₃AlF₆) حل میشود تا دمای ذوب کاهش یابد.
- محلول مذاب در یک سلول الکترولیتی نگهداری میشود.
- کاتد، جداره کربنی مخزن است و آند نیز میلههای کربنی درون سلول هستند.
- با عبور جریان برق، یونهای Al³⁺ به کاتد مهاجرت کرده و به آلومینیوم فلزی کاهش مییابند.
واکنشهای شیمیایی در فرایند هال
در کاتد (کاهش):
Al³⁺ + 3e⁻ → Al (مایع)
در آند (اکسایش):
⁻2O²⁻ → O₂ + 4e
اکسیژن حاصل با آند کربنی واکنش داده و دیاکسید کربن تولید میکند:
C + O₂ → CO₂
نکات مهم فرایند هال
- دمای عملیاتی حدود ۹۵۰ تا ۱۰۰۰ درجه سانتیگراد است.
- کریولیت باعث کاهش دمای ذوب آلومینا میشود و از اتلاف انرژی جلوگیری میکند.
- آندهای کربنی بهمرور مصرف میشوند و باید جایگزین شوند.
- آلومینیوم تولیدی در کف سلول جمع میشود و بهصورت دورهای تخلیه میگردد.
مزایای آلومینیوم تولیدی با فرایند هال
- خلوص بالا
- تولید صنعتی در مقیاس وسیع
- بازیافتپذیری آسان
- کاربرد گسترده در صنایع هوافضا، حملونقل، بستهبندی، ساختمان و لوازم خانگی
معایب فرایند هال
- مصرف انرژی بسیار بالا
- تولید گازهای گلخانهای مانند CO₂
- نیاز به جایگزینی مداوم آندهای کربنی
- فرآیند نسبتاً پرهزینه
جمعبندی
فرایند هال یک روش الکترولیتی حیاتی برای تولید آلومینیوم خالص از آلومینا است. این فرآیند با حل کردن Al₂O₃ در کریولیت مذاب و اعمال جریان برق، آلومینیوم را در مقیاس صنعتی استخراج میکند. با وجود مصرف انرژی بالا، این روش همچنان اصلیترین روش تولید آلومینیوم در جهان محسوب میشود.