مایعات و جامدات دو حالت اصلی ماده هستند که رفتار و ویژگیهای منحصربهفردی دارند. درک نیروهای بینمولکولی، فشار بخار، دمای جوش و ساختارهای بلوری برای شناخت بهتر این فازهای ماده ضروری است.
1. نیروهای جاذبه بین مولکولی
نیروهای بینمولکولی مسئول تعیین خواص فیزیکی مایعات و جامدات هستند. این نیروها شامل:
- نیروهای واندروالس (London Dispersion Forces): ناشی از تغییرات لحظهای در توزیع الکترونی مولکولها هستند.
- نیروهای دوقطبی-دوقطبی: در مولکولهای قطبی دیده میشوند که یک انتهای مثبت یک مولکول به انتهای منفی مولکول دیگر جذب میشود.
- پیوند هیدروژنی: نوعی نیروی قوی بین مولکولهایی که اتم هیدروژن به اتمهای الکترونگاتیوی مانند نیتروژن، اکسیژن یا فلوئور متصل است.
2. پیوند هیدروژنی
پیوند هیدروژنی تأثیر زیادی بر خواص مایعات و جامدات دارد. برخی از نتایج این پیوند عبارتاند از:
- افزایش نقطه جوش در آب و الکلها
- تأثیر در ساختار DNA
- پایداری پروتئینها
3. حالت مایع
مایعات دارای حجم ثابت اما شکل متغیر هستند و تحت تأثیر نیروهای بینمولکولی قرار دارند. ویژگیهای مهم آنها شامل چسبندگی (ویسکوزیته) و کشش سطحی است.
4. تبخیر و فشار بخار
تبخیر فرآیندی است که طی آن مولکولهای سطحی مایع انرژی کافی برای فرار از سطح به دست میآورند. میزان تبخیر به فشار بخار بستگی دارد که بر اساس رابطه کلی کلوزیوس-کلاپیرون محاسبه میشود:
ln(P2 / P1) = (-ΔHvap / R) * (1/T2 – 1/T1)
که در آن:
که در آن:
P1وP2= فشار بخار در دماهایT1وT2(بر حسب کلوین)ΔHvap= آنتالپی تبخیر (بر حسب ژول بر مول)R= ثابت گازها (8.314 J/(mol·K))
5. دمای جوش و آنتالپی تبخیر
دمای جوش دمایی است که در آن فشار بخار مایع برابر با فشار محیط میشود. آنتالپی تبخیر مقدار انرژی لازم برای تبدیل یک مول از مایع به گاز است.
6. دمای انجماد
دمای انجماد دمایی است که در آن مایع به جامد تبدیل میشود. این دما تحت تأثیر فشار و نیروهای بینمولکولی قرار دارد.
7. فشار بخار یک جامد
برخی جامدات مانند یخ یا ید مستقیماً از حالت جامد به گاز تبدیل میشوند (تصعید). فشار بخار یک جامد معمولاً پایینتر از مایعات است و به ساختار آن بستگی دارد.
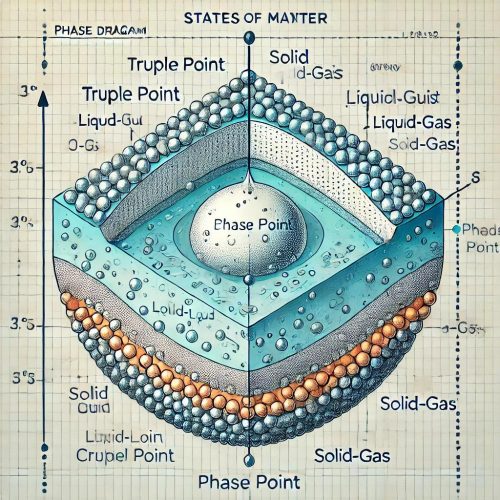
8. نمودارهای فاز
نمودار فاز، نموداری است که حالتهای مختلف ماده (جامد، مایع و گاز) را در دماها و فشارهای مختلف نشان میدهد. این نمودار اطلاعات مهمی درباره تعادل بین فازهای ماده و نقاط کلیدی مانند نقطه سهگانه و نقطه بحرانی ارائه میدهد.
اجزای اصلی نمودار فاز:
- خطوط تعادل فازی: این خطوط نشان میدهند که در چه دما و فشاری دو فاز مختلف در تعادل هستند.
- نقطه سهگانه: نقطهای که در آن سه فاز ماده (جامد، مایع و گاز) همزمان در تعادل هستند.
- نقطه بحرانی: نقطهای که در دمای بالاتر از آن، فاز مایع و گاز از هم قابل تفکیک نیستند و به یک سیال فوق بحرانی تبدیل میشوند.
9. انواع جامدات بلوری
جامدات بلوری بر اساس نوع پیوندهای بینمولکولی و ساختار داخلی به گروههای زیر تقسیم میشوند:
- بلورهای یونی: متشکل از یونهای مثبت و منفی (مانند NaCl)
- بلورهای فلزی: دارای الکترونهای آزاد که باعث رسانایی الکتریکی بالا میشوند.
- بلورهای مولکولی: از مولکولهای منفرد تشکیل شدهاند و نیروهای واندروالس آنها را کنار هم نگه میدارند (مانند یخ)
- بلورهای کووالانسی شبکهای: دارای پیوندهای کووالانسی قوی در کل شبکه هستند (مانند الماس و سیلیسیم دیاکسید)
10. بلورها و تعیین ساختار آنها با پراش اشعه ایکس
پراش اشعه ایکس تکنیکی برای تعیین ساختار بلوری است. الگوی پراش تولیدشده توسط کریستال میتواند اطلاعاتی درباره فواصل اتمی و نظم بلور ارائه دهد. رابطه براگ در این زمینه استفاده میشود:
nλ=2dsinθ
که در آن:
- n عدد صحیح
- λ طول موج اشعه ایکس
- d فاصله صفحههای بلوری
- θ زاویه پراش
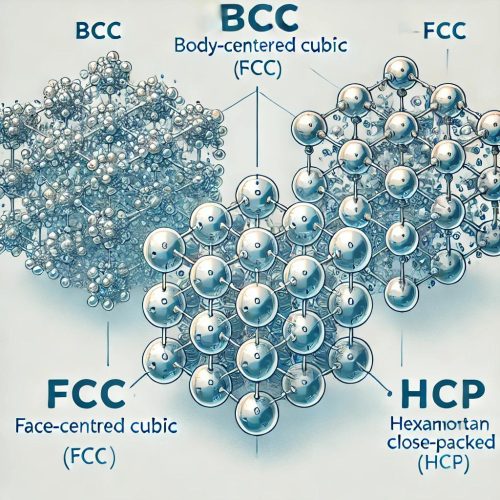
11. ساختار بلوری فلزات
فلزات دارای ساختارهای بلوری منظم و متراکم هستند که باعث ایجاد ویژگیهایی مانند استحکام، رسانایی الکتریکی و انعطافپذیری میشود. ساختار بلوری فلزات معمولاً به سه نوع اصلی تقسیم میشود:
1. شبکه مکعبی مرکزپر (BCC – Body-Centered Cubic)
در این ساختار، اتمها در گوشههای یک مکعب قرار گرفته و یک اتم در مرکز آن قرار دارد. این ساختار باعث سختی و شکنندگی بیشتر فلزات میشود.
نمونهها: آهن (Fe) در دمای بالا، کروم (Cr)، تنگستن (W)
2. شبکه مکعبی وجهپر (FCC – Face-Centered Cubic)
در این ساختار، اتمها در گوشههای مکعب و همچنین در مرکز هر وجه مکعب قرار دارند. این ساختار باعث چگالی بالا و انعطافپذیری بیشتر فلزات میشود.
نمونهها: آلومینیوم (Al)، مس (Cu)، طلا (Au)
3. شبکه هگزاگونال متراکم (HCP – Hexagonal Close-Packed)
در این ساختار، اتمها در یک آرایش ششضلعی فشرده قرار میگیرند. این ساختار باعث استحکام بالا و انعطافپذیری کمتر میشود.
نمونهها: منیزیم (Mg)، تیتانیوم (Ti)، روی (Zn)
ویژگیهای ساختار بلوری فلزات:
- چگالی بالا: به دلیل آرایش فشرده اتمها
- رسانایی الکتریکی و حرارتی بالا: به دلیل وجود الکترونهای آزاد
- انعطافپذیری و چکشخواری: وابسته به نوع شبکه بلوری
فلزات دارای ساختار بلوری متراکم با آرایشهای مکعبی مرکزپر (BCC)، مکعبی وجهپر (FCC) و ششضلعی فشرده (HCP) هستند.
12. بلورهای یونی
بلورهای یونی مانند NaCl از یونهای مثبت و منفی تشکیل شدهاند که توسط نیروی الکترواستاتیک در کنار هم قرار گرفتهاند.
13. ساختارهای ناقص در بلورها
بلورها میتوانند شامل نقصهایی مانند نقص جایخالی، نقص بیننشینی، نقص فرانکل و نقص شاتکی باشند که بر خواص مکانیکی و الکتریکی مواد تأثیر میگذارند.
نتیجهگیری
مایعات و جامدات دارای خواص فیزیکی و شیمیایی منحصربهفردی هستند که با نیروهای بینمولکولی، فشار بخار، تغییرات فازی و ساختار بلوری مرتبطاند. درک این ویژگیها در علم مواد، شیمی و مهندسی کاربرد گستردهای دارد.