مقدمه
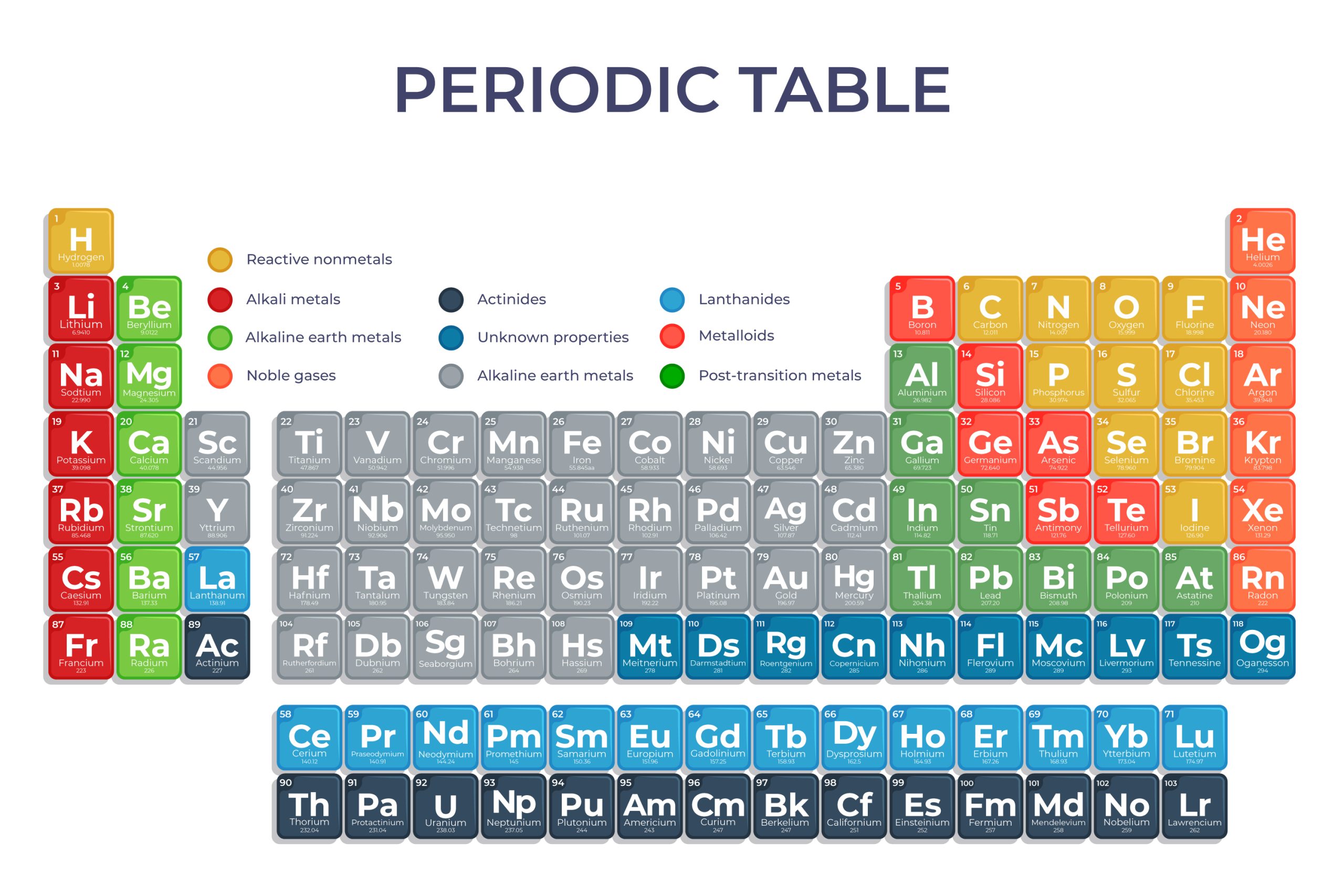
قانون دورهای عناصر یکی از بنیادیترین اصول در شیمی است که نظم و ویژگیهای مشترک بین عناصر را توضیح میدهد. این قانون که توسط دیمیتری مندلیف در قرن نوزدهم ارائه شد، بیان میکند که خواص فیزیکی و شیمیایی عناصر بهطور دورهای با افزایش عدد اتمی تغییر میکنند. این مقاله به بررسی این قانون، تأثیر آن بر چیدمان جدول تناوبی و کاربردهای آن در علوم مختلف میپردازد.
1. تاریخچه و پیدایش قانون دورهای
در سال 1869، دیمیتری مندلیف با مطالعه خواص عناصر شناختهشده و مرتبسازی آنها بر اساس جرم اتمی، متوجه تکرار دورهای ویژگیهای آنها شد. او جدولی طراحی کرد که در آن عناصر مشابه در یک گروه قرار میگرفتند. بعدها، هنری موزلی با کشف عدد اتمی، جدول را اصلاح کرد و قانون دورهای را بر اساس عدد اتمی بیان نمود.
2. اصول قانون دورهای
قانون دورهای بیان میکند که خواص عناصر بهطور منظم و تکرارشونده در جدول تناوبی تغییر میکنند. این تغییرات شامل موارد زیر است:
الف) تغییرات شعاع اتمی
شعاع اتمی در یک دوره از چپ به راست کاهش و در یک گروه از بالا به پایین افزایش مییابد. علت این تغییر، افزایش بار هستهای و تعداد لایههای الکترونی است.
ب) انرژی یونش
انرژی یونش، میزان انرژی لازم برای جدا کردن یک الکترون از اتم است. این انرژی در طول یک دوره افزایش و در یک گروه کاهش مییابد، زیرا نیروی جاذبه هسته بر الکترونهای ظرفیت تأثیر میگذارد.
ج) الکتروندوستی و الکترونگاتیوی
الکتروندوستی به تمایل یک اتم برای جذب الکترون در یک پیوند شیمیایی گفته میشود. این ویژگی از چپ به راست در یک دوره افزایش و از بالا به پایین در یک گروه کاهش مییابد. بیشترین مقدار الکترونگاتیوی متعلق به فلوئور است.
د) خواص فلزی و نافلزی
فلزات تمایل زیادی به از دست دادن الکترون دارند، در حالی که نافلزات تمایل به جذب الکترون دارند. این ویژگیها بهطور دورهای در جدول تغییر میکنند، بهطوری که عناصر فلزی در سمت چپ و نافلزات در سمت راست جدول قرار دارند.
3. تأثیر قانون دورهای بر رفتار شیمیایی
این قانون به دانشمندان کمک میکند تا واکنشپذیری عناصر را پیشبینی کرده و ترکیبات جدیدی را طراحی کنند. برخی از مهمترین کاربردهای آن عبارتاند از:
- پیشبینی ترکیبات شیمیایی: شیمیدانان میتوانند با بررسی موقعیت یک عنصر در جدول تناوبی، واکنشهای احتمالی آن را حدس بزنند.
- کاربرد در صنایع مختلف: از قانون دورهای در مهندسی مواد، پزشکی و صنایع الکترونیک برای توسعه مواد جدید و بهینهسازی فرآیندها استفاده میشود.
- کشف عناصر جدید: دانشمندان با بررسی روندهای دورهای، ویژگیهای عناصر ناشناخته را پیشبینی کرده و ترکیبات جدیدی را سنتز میکنند.
نتیجهگیری
قانون دورهای عناصر، بنیان درک نظم و ساختار جدول تناوبی است. این قانون نهتنها راهنمایی برای پیشبینی خواص عناصر فراهم میکند، بلکه در توسعه فناوریهای جدید و کشف مواد پیشرفته نقش اساسی دارد. با شناخت بهتر این الگوها، میتوان از علم شیمی در حوزههای گستردهای بهره برد.