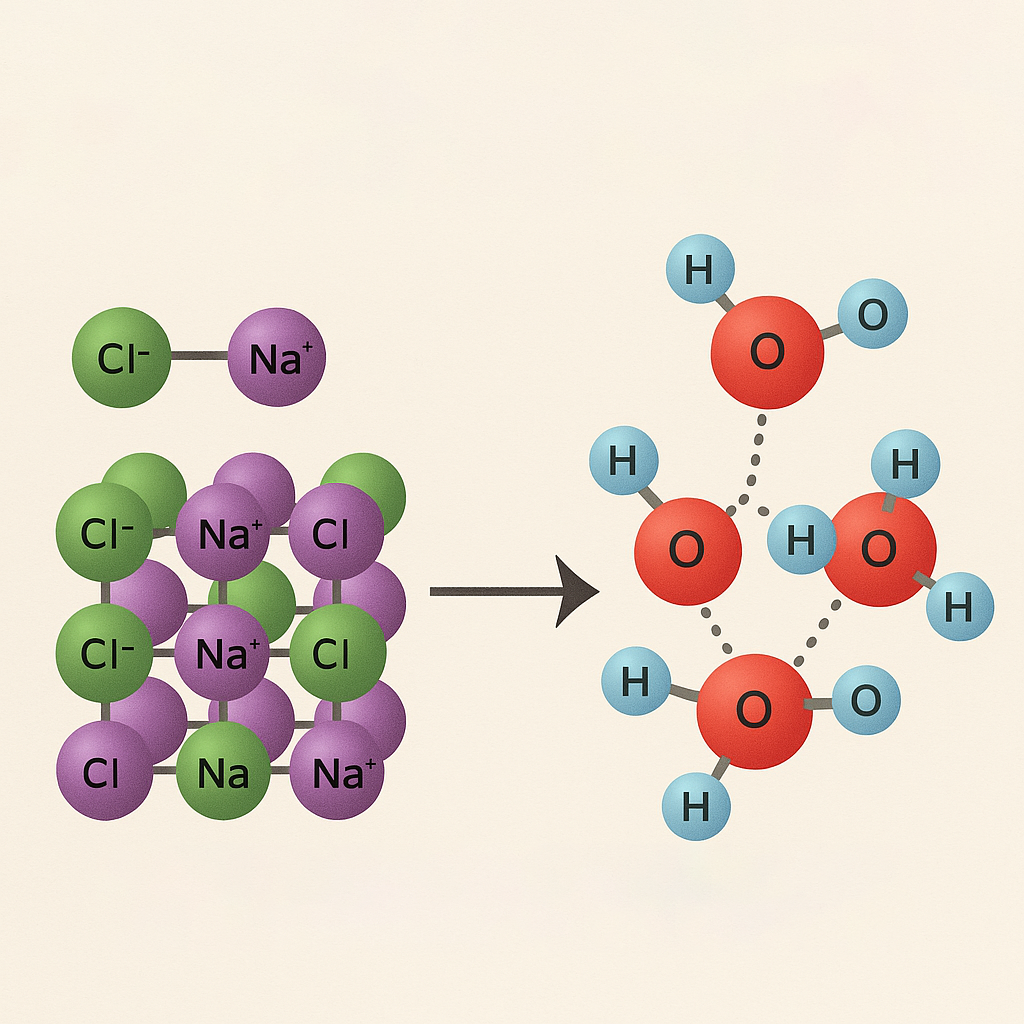
مقدمه
انحلال نمکها در آب یک فرایند رایج و حیاتی در علوم شیمی و زیستشناسی است که در بسیاری از واکنشهای طبیعی و صنعتی نقش اساسی دارد. درک نحوه تعامل یونها با مولکولهای آب به ما کمک میکند تا رفتار محلولهای یونی را بهتر بشناسیم.
مکانیسم انحلال نمکها در آب
هنگامی که یک نمک یونی (مانند کلرید سدیم) در آب ریخته میشود، مولکولهای آب با یونهای مثبت و منفی آن برهمکنش میکنند و باعث جدا شدن یونها از ساختار بلوری نمک میشوند. این فرایند شامل سه مرحله اصلی است:
- شکستن شبکه بلوری نمک: یونها از یکدیگر جدا میشوند که نیاز به انرژی دارد.
- تشکیل پیوندهای جدید با آب: مولکولهای آب به دور یونها تجمع میکنند.
- آبپوشی یونها: هر یون با لایههایی از مولکولهای آب احاطه میشود که باعث پایداری محلول میگردد.
نقش یونهای دوقطبی در انحلال
آب به عنوان یک مولکول دوقطبی دارای دو انتهای دارای بار جزئی مثبت و منفی است. هنگام انحلال، انتهای منفی آب (اکسیژن) به سمت کاتیونهای مثبت و انتهای مثبت آن (هیدروژن) به سمت آنیونهای منفی جذب میشود. این تعامل قوی باعث شکستن پیوندهای بین یونها در بلور نمک و آزاد شدن آنها در محلول میشود.
پدیده آبپوشی یونها
آبپوشی یا هیدراتاسیون یونها به فرایندی گفته میشود که در آن مولکولهای آب اطراف یونها را احاطه میکنند و یک لایه پایدار تشکیل میدهند. تعداد مولکولهای آب در این لایه به اندازه و بار یون بستگی دارد. آبپوشی یونها موجب افزایش پایداری یونها در محلول و جلوگیری از بازگشت آنها به حالت جامد میشود.
انحلال یونی
انحلال یونی فرایندی است که در آن یک ترکیب یونی در آب یا یک حلال قطبی دیگر حل شده و به یونهای سازنده خود تجزیه میشود. این فرایند برای نمکهای محلول مانند کلرید سدیم (NaCl) به این صورت انجام میشود که یونهای مثبت (کاتیونها) و یونهای منفی (آنیونها) از هم جدا شده و درون محلول پراکنده میشوند.
مکانیسم انحلال یونی
فرایند انحلال یونی شامل چند مرحله اساسی است:
شکستن شبکه بلوری:
-
- در یک ترکیب یونی مانند NaCl، یونهای Na⁺ و Cl⁻ با نیروی جاذبه الکترواستاتیکی در کنار هم قرار دارند و ساختار بلوری جامد را تشکیل میدهند.
- برای حل شدن، این پیوندهای قوی باید شکسته شوند که نیاز به انرژی دارد (انرژی شبکه بلوری).
برهمکنش با مولکولهای حلال (آبپوشی یونها):
-
- مولکولهای آب به دلیل داشتن خاصیت دوقطبی، یونهای جداشده را احاطه میکنند.
- انتهای منفی مولکول آب (اکسیژن) به کاتیونها (مثلاً Na⁺) و انتهای مثبت آن (هیدروژن) به آنیونها (مثلاً Cl⁻) متصل میشود.
پایدار شدن یونها در محلول:
-
- پس از جدا شدن یونها و آبپوشی آنها، یونها به صورت پایدار در محلول باقی میمانند.
- این حالت باعث جلوگیری از بازگشت یونها به ساختار بلوری میشود.
عوامل مؤثر بر انحلال یونی
- قطبیت حلال: هرچه قطبیت حلال بیشتر باشد، توانایی آن برای حل کردن ترکیبات یونی بیشتر خواهد بود (مثلاً آب یک حلال بسیار قطبی است).
- دمای محلول: در برخی موارد، افزایش دما انحلالپذیری را افزایش میدهد.
- ساختار و انرژی شبکه بلوری: هرچه پیوندهای بین یونها در بلور قویتر باشد، سختتر حل میشوند.
نتیجهگیری
فرایند انحلال نمکها در آب تحت تأثیر نیروهای بینمولکولی و نقش یونهای دوقطبی انجام میشود. آب به عنوان یک حلال قطبی، یونهای آزاد شده را احاطه کرده و از بازترکیب آنها جلوگیری میکند. درک این مکانیسم برای مطالعه واکنشهای شیمیایی، طراحی داروها و بسیاری از کاربردهای صنعتی اهمیت دارد.