مقدمه
در دنیای الکتروشیمی، سلول گالوانی ابزاری است که از طریق واکنشهای شیمیایی، برق تولید میکند. یکی از معروفترین نمونههای تاریخی آن، سلول دانز (Daniell Cell) است. این سلول، اختراعی از قرن نوزدهم است که هنوز هم به عنوان یک مدل مفهومی برای درک بهتر مباحث اکسایش و کاهش، الکترود و ولتاژ استاندارد در کتابهای شیمی آموزش داده میشود.
سلول دانز چیست؟
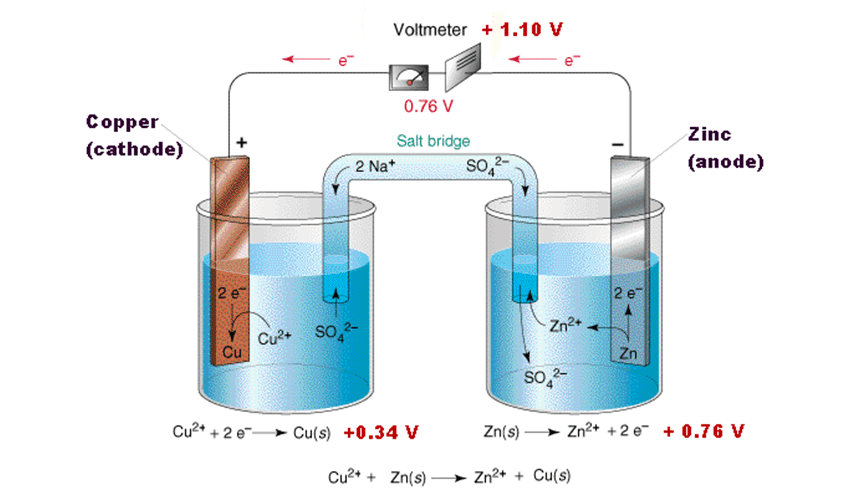
سلول دانز یک نوع سلول گالوانی است که در آن انرژی شیمیایی به انرژی الکتریکی تبدیل میشود. این سلول از دو نیمسلول تشکیل شده است:
- نیمسلول روی (Zn): آند (محل اکسایش)
- نیمسلول مس (Cu): کاتد (محل کاهش)
ترکیبات تشکیلدهنده سلول دانز
| بخش | ترکیب/ماده |
|---|---|
| آند (منفی) | الکترود روی (Zn) در محلول ZnSO₄ |
| کاتد (مثبت) | الکترود مس (Cu) در محلول CuSO₄ |
| پل نمکی | لولهای حاوی محلول یونی مانند KNO₃ یا NaCl برای برقراری تعادل بار و جریان یونها |
واکنشهای سلول دانز
معادله کلی:
Zn(s) + Cu²⁺(aq) → Zn²⁺(aq) + Cu(s)
واکنش در آند (اکسایش):
⁻Zn(s) → Zn²⁺(aq) + 2e
واکنش در کاتد (کاهش):
Cu²⁺(aq) + 2e⁻ → Cu(s)
نحوه عملکرد سلول دانز
- در آند (الکترود روی)، اتمهای روی الکترون از دست میدهند (اکسایش) و به صورت یون Zn²⁺ وارد محلول میشوند.
- الکترونهای آزادشده از طریق سیم به سمت کاتد (الکترود مس) حرکت میکنند.
- در کاتد، یونهای Cu²⁺ موجود در محلول الکترون دریافت کرده و به مس فلزی تبدیل میشوند که روی الکترود رسوب میکند.
- پل نمکی با جابهجایی یونها، مانع از تجمع بار الکتریکی شده و جریان را پایدار نگه میدارد.
مزایا و اهمیت سلول دانز
معرفی نخستین ساختار باتری قابل اعتماد
پایهای برای درک واکنشهای ردوکس
آموزش عملی مفاهیم الکترود، آند، کاتد، و ولتاژ سلول
الهامبخش باتریهای مدرن در قرنهای بعد
نکته مهم درباره جهت جریان
- جهت حرکت الکترونها: از آند (Zn) به کاتد (Cu)
- جهت جریان الکتریکی خارجی (در مدار): از کاتد (مثبت) به آند (منفی)
ولتاژ استاندارد سلول دانز
برای محاسبه ولتاژ استاندارد (E°cell)، از پتانسیل الکترودی استاندارد استفاده میکنیم:
E°cell = E° کاتد – E° آند
E°cell = (+0.34 V) – (-0.76 V) = +1.10 V
جمعبندی
سلول دانز نهتنها یک اختراع مهم در تاریخ الکتروشیمی است، بلکه یک ابزار آموزشی مؤثر برای درک مفاهیم بنیادی تولید جریان الکتریکی، واکنشهای اکسایش و کاهش و عملکرد سلولهای گالوانی به شمار میرود. این سلول هنوز هم در آزمایشگاهها برای آموزش پایهای الکتروشیمی کاربرد دارد.