یون هیدرونیوم (⁺H₃O): چهره واقعی یون ⁺H در آب
مقدمه
زمانی که درباره اسیدها صحبت میکنیم، معمولاً از یون ⁺H (پروتون) به عنوان عامل اسیدی نام میبریم. اما در واقعیت، یون ⁺H در آب به شکل آزاد وجود ندارد. آنچه واقعاً در محلول آبی وجود دارد، یون هیدرونیوم (⁺H₃O) است. شناخت این یون، گامی مهم در درک واکنشهای اسید و باز و رفتار محلولها در شیمی است.
یون هیدرونیوم چیست؟
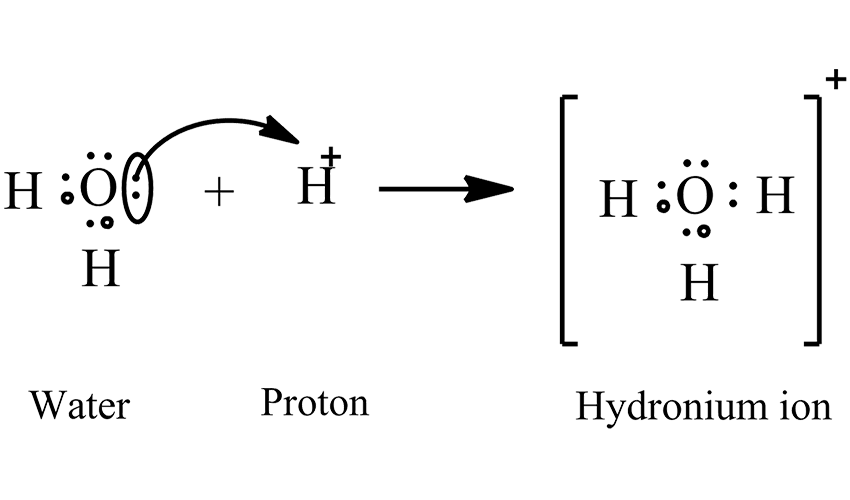
یون هیدرونیوم زمانی تشکیل میشود که یک مولکول آب، یون هیدروژن (H⁺) را جذب میکند:
⁺H⁺ + H₂O → H₃O
در واقع یون ⁺H بسیار کوچک، ناپایدار و پرانرژی است. بنابراین بلافاصله با آب واکنش میدهد و به یون پایدارتر ⁺H₃O تبدیل میشود.
ساختار یون هیدرونیوم
یون هیدرونیوم شامل سه اتم هیدروژن و یک اتم اکسیژن است.
ساختار آن شبیه به یک مولکول آب است که یک پروتون اضافه دریافت کرده باشد.
پیوندها در ⁺H₃O کووالانسی بوده و بار مثبت آن بر روی اکسیژن متمرکز میشود.
نقش هیدرونیوم در تعریف اسید
بر اساس نظریه آرنیوس و نظریههای بعدی مانند برونستد-لوری، اسید مادهای است که در آب پروتون (⁺H) آزاد میکند. اما چون این پروتون بلافاصله با آب واکنش میدهد، در واقع چیزی که ما در محلول آبی مشاهده میکنیم، افزایش غلظت ⁺H₃O است.
برای نمونه:
⁻HCl + H₂O → H₃O⁺ + Cl
در این معادله، HCl بهعنوان اسید، پروتون خود را به مولکول آب منتقل کرده و یون هیدرونیوم تولید میشود.
هیدرونیوم و مقدار pH
یکی از مهمترین مفاهیم مرتبط با یون هیدرونیوم، عدد pH است که میزان اسیدی یا بازی بودن محلول را نشان میدهد:
pH = -log[H₃O⁺]
یعنی هرچه غلظت یون هیدرونیوم بیشتر باشد، pH کمتر و محلول اسیدیتر خواهد بود. برای مثال:
[H₃O⁺] = 1 × 10⁻⁷ mol/L → pH = 7 (خنثی)
[H₃O⁺] = 1 × 10⁻³ mol/L → pH = 3 (اسیدی)
مقایسه یون H⁺ و H₃O⁺
| ویژگی | یون H⁺ | یون H₃O⁺ |
|---|---|---|
| ترکیب | فقط پروتون | پروتون پیوسته به یک مولکول آب |
| پایداری | بسیار ناپایدار | پایدارتر در آب |
| وجود در آب | وجود ندارد به تنهایی | شکل واقعی یون در آب |
| کاربرد در معادلات | تئوری و سادهسازیشده | دقیقتر و علمیتر |
کاربردهای یون هیدرونیوم
1. اندازهگیری pH: اساس تعریف pH به غلظت ⁺H₃O وابسته است.
2. تحلیل اسیدها: بررسی قدرت اسیدی، تفکیک و رسانایی الکترولیتی با توجه به مقدار ⁺ H₃Oانجام میشود.
3. واکنشهای تعادلی: در معادلات تعادلی مانند آبپوشی یا تعادل اسیدی-بازی، یون هیدرونیوم نقش کلیدی دارد.
نتیجهگیری
یون هیدرونیوم، نماینده واقعی یون ⁺H در محلول آبی است و نقشی اساسی در فهم شیمی اسید و باز، محاسبه pH و تحلیل محلولها دارد. هرچند در معادلات ساده از H⁺ استفاده میکنیم، اما در دنیای واقعی این ⁺H₃O است که حاکم محلولهای آبی اسیدی است.