مقدمه
آمونیاک (Ammonia) با فرمول شیمیایی NH₃ یک ترکیب گازی بیرنگ با بویی تند و نافذ است. این ماده یکی از پایههای مهم در شیمی صنعتی و کشاورزی است و بهدلیل خواص بازی خود، در بسیاری از واکنشها بهعنوان باز ضعیف شرکت میکند.
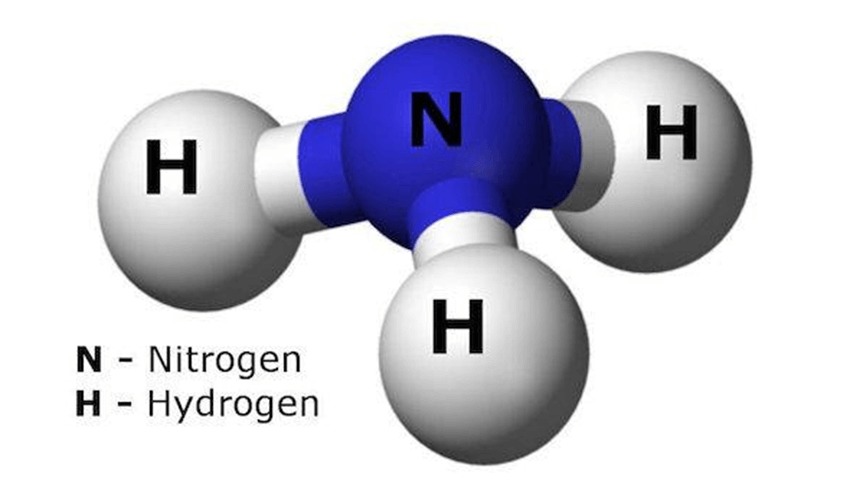
ساختار مولکولی آمونیاک
فرمول شیمیایی: NH₃
شامل یک اتم نیتروژن و سه اتم هیدروژن
نیتروژن دارای یک جفت الکترون آزاد است
زاویه پیوندی: حدود 107 درجه (شکل هرمی)
ساختار آمونیاک باعث میشود این مولکول قطبی باشد و خاصیت بازی داشته باشد.
خواص فیزیکی و شیمیایی آمونیاک
| ویژگی | مقدار / توضیح |
|---|---|
| حالت فیزیکی | گاز بیرنگ |
| بو | تند و نافذ |
| انحلالپذیری در آب | بالا |
| pH محلول | قلیایی (pH حدود 11 برای محلول رقیق) |
| فراریت | بالا |
| سمیت | در غلظتهای بالا سمی است |
آمونیاک بهعنوان باز ضعیف
آمونیاک در آب حل میشود و بخشی از آن یونیزه میشود:
⁻NH₃ + H₂O ⇌ NH₄⁺ + OH
واکنش برگشتپذیر است
به همین دلیل، آمونیاک باز ضعیف محسوب میشود
محلول آمونیاک در آب، یک محلول قلیایی است
روشهای تهیه آمونیاک
۱. سنتز صنعتی – فرآیند هابر (Haber Process):
N₂ + 3H₂ ⇌ 2NH₃ (در دمای حدود ۴۵۰ درجه و فشار بالا با کاتالیزور آهن)
این واکنش از نیتروژن هوا و هیدروژن به دست میآید و یکی از مهمترین واکنشهای شیمیایی صنعتی جهان است.
۲. تولید خانگی (در محلولهای تمیزکننده)
آمونیاک رقیق در تمیزکنندهها یافت میشود که از نظر غلظت بسیار پایین و ایمنتر است.
کاربردهای آمونیاک
| کاربرد | توضیح |
|---|---|
| کودهای کشاورزی | برای تولید اوره، آمونیوم نیترات و … |
| تمیزکنندهها | در پاککنندههای خانگی و صنعتی |
| ساخت مواد شیمیایی | مانند تولید اسید نیتریک |
| تبرید (سردسازی) | بهعنوان مبرد در سیستمهای قدیمی یخچال و چیلر |
| صنایع داروسازی | در تولید داروهای خاص |
| تصفیه آب | برای حذف ناخالصیها بههمراه کلر |
ایمنی در کار با آمونیاک
گاز آمونیاک سمی است و استنشاق آن در غلظت بالا خطرناک میباشد
تماس مستقیم با پوست یا چشم ممکن است موجب تحریک یا سوختگی شود
باید در محیط دارای تهویه مناسب و با تجهیزات ایمنی استفاده شود
جمعبندی
آمونیاک ترکیبی پرکاربرد در دنیای شیمی و صنعت است که هم در مقیاس آزمایشگاهی و هم صنعتی استفاده میشود. با درک ساختار، خواص و نحوه استفاده ایمن از این ماده، میتوان از مزایای گسترده آن بهره برد و در عین حال خطرات احتمالی را کاهش داد.