مقدمه
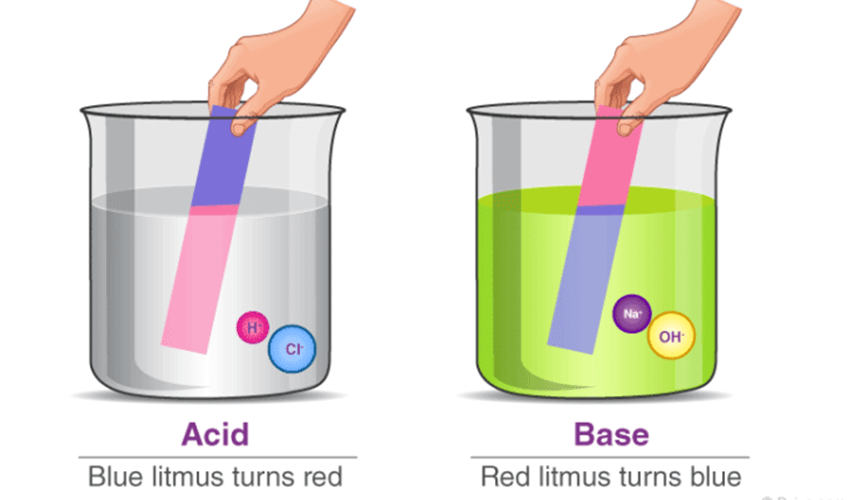
بازها (Bases) دستهای از مواد شیمیایی هستند که در محلول آبی یون هیدروکسید (⁻OH) آزاد میکنند یا توانایی پذیرش پروتون (⁺H) دارند. این ترکیبات برخلاف اسیدها عمل میکنند و معمولاً طعمی تلخ دارند و حالت لغزندگی روی پوست ایجاد میکنند. در این مقاله با بازها، انواع آنها، pH بازها، و کاربردهای آنها آشنا میشویم.
pH بازها در مقیاس اسید-باز
بازها موادی هستند که pH بالاتر از ۷ دارند و در محدوده ۷ تا ۱۴ قرار میگیرند.
| بازه pH | نوع محلول |
|---|---|
| کمتر از ۷ | اسیدی |
| برابر با ۷ | خنثی (مثل آب خالص) |
| بیشتر از ۷ تا ۱۴ | بازی (قلیایی) |
باز قوی و باز ضعیف چیست؟
باز قوی (Strong Base):
بازهایی هستند که در محلول آبی به طور کامل یونیزه میشوند و یونهای ⁻ OH زیادی آزاد میکنند.
مثالها:
سدیم هیدروکسید (NaOH)
پتاسیم هیدروکسید (KOH)
باریم هیدروکسید (Ba(OH)₂)
باز ضعیف (Weak Base):
بازهایی هستند که به صورت ناقص در آب یونیزه میشوند و فقط بخش کوچکی از مولکولهای آنها یون ⁻OH تولید میکنند.
مثالها:
آمونیاک (NH₃)
پیریدین (C₅H₅N)
متیلآمین (CH₃NH₂)
فرمول یونش آمونیاک:
⁻NH₃ + H₂O ⇌ NH₄⁺ + OH
توجه: علامت ⇌ نشان میدهد که واکنش برگشتپذیر است و به تعادل میرسد، ویژگی بازهای ضعیف.
باز آلی چیست؟
بازهای آلی، ترکیبات آلیای هستند که خاصیت بازی دارند. اغلب شامل **اتم نیتروژن با یک جفتالکترون آزاد** هستند که میتواند پروتون (H⁺) را جذب کند.
ویژگیهای باز آلی:
دارای ساختار کربنی
حاوی گروههای آمینی (–NH₂ یا مشتقات آن)
معمولاً باز ضعیف هستند
کاربرد وسیع در شیمی دارویی و بیوشیمی
مثالهایی از بازهای آلی:
آمونیاک (NH₃) → سادهترین باز آلی
آنیلین (C₆H₅NH₂) → باز آلی آروماتیک
تریاتیلآمین (N(CH₂CH₃)₃) → باز آلی قویتر در بین آمینها
کاربردهای بازها در زندگی روزمره
بازها کاربردهای فراوانی دارند:
| ماده | نوع باز | کاربرد |
|---|---|---|
| NH₃ (آمونیاک) | باز ضعیف آلی | پاککننده خانگی |
| NaOH | باز قوی معدنی | ساخت صابون |
| Mg(OH)₂ | باز ضعیف | آنتیاسید برای کاهش اسیدیته معده |
| آمینها | باز آلی | سنتز داروها، مواد آرایشی، رنگها |
جمعبندی
بازها ترکیباتی با pH بین ۷ تا ۱۴ هستند که نقش مهمی در شیمی، زیست، صنایع و زندگی روزمره دارند. شناخت تفاوت میان بازهای قوی و ضعیف، و بهویژه بازهای آلی، به درک بهتر رفتار این مواد در واکنشهای شیمیایی کمک میکند. اگرچه بسیاری از بازها بیخطر هستند، اما برخی از آنها (مانند NaOH) خورندهاند و باید با احتیاط استفاده شوند.