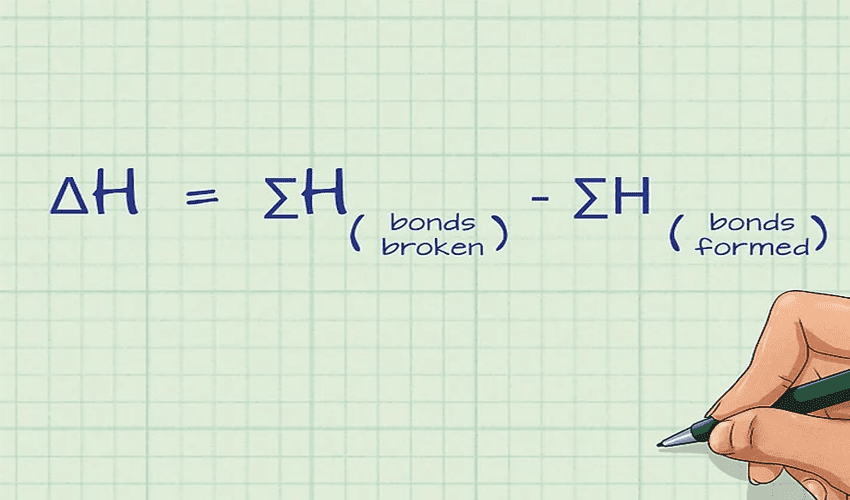آنتالپی پیوند چیست؟
آنتالپی پیوند (Bond Enthalpy) یا انرژی پیوند، به مقدار انرژی لازم برای شکستن یک مول از پیوندهای خاص در حالت گازی گفته میشود. این انرژی معمولاً بر حسب کیلوژول بر مول (kJ/mol) بیان میشود.
مثال:
برای شکستن یک پیوند H–H در مولکول هیدروژن، باید حدود 436 kJ/mol انرژی صرف شود.
تعریف سادهتر:
وقتی دو اتم با هم پیوند دارند، انرژی برای نگهداشتن آنها کنار هم وجود دارد. برای شکستن این پیوند و جدا کردن اتمها، باید انرژی وارد شود. مقدار این انرژی، همان آنتالپی شکستن پیوند است.
فرمول محاسبه آنتالپی واکنش با استفاده از آنتالپی پیوند:
ΔH = مجموع انرژیهای پیوندهای شکسته شده − مجموع انرژیهای پیوندهای تشکیل شده
یا بهصورت ساده:
ΔH = ∑(Bonds broken) − ∑(Bonds formed)
توجه: تمام مقادیر باید برای حالت گازی باشند.
آنتالپی میانگین پیوند چیست؟
در مولکولهایی مثل H₂O یا CH₄، همه پیوندهای O–H یا C–H دقیقاً یکسان نیستند. به همین دلیل، برای کاربردهای عمومی از میانگین آنتالپی پیوند (Average Bond Enthalpy) استفاده میشود.
مثال:
آنتالپی میانگین پیوند C–H تقریباً 412 kJ/mol است، ولی این مقدار ممکن است بسته به مولکول، کمی متفاوت باشد.
چند مقدار میانگین آنتالپی پیوند مهم:
| نوع پیوند | میانگین آنتالپی (kJ/mol) |
|---|---|
| H–H | 436 |
| O=O | 498 |
| C–H | 412 |
| C=C | 612 |
| C≡C | 837 |
| N≡N | 945 |
مثال کاربردی:
محاسبه آنتالپی واکنش زیر با استفاده از آنتالپی پیوندها:
CH₄ + 2O₂ → CO₂ + 2H₂O
مرحله اول: شکستن پیوندها در سمت چپ (واکنشدهندهها)
- 4 پیوند C–H → 4 × 412 = 1648 kJ
- 2 پیوند O=O → 2 × 498 = 996 kJ
جمع: 1648 + 996 = 2644 kJ
مرحله دوم: تشکیل پیوندها در سمت راست (محصولات)
- 2 پیوند C=O در CO₂ → 2 × 799 = 1598 kJ
- 4 پیوند O–H در 2H₂O → 4 × 463 = 1852 kJ
جمع: 1598 + 1852 = 3450 kJ
ΔH = 2644 – 3450 = -806 kJ
=> واکنش گرماده است.
جمعبندی:
- آنتالپی پیوند، نشاندهنده انرژی لازم برای شکستن پیوند بین دو اتم است.
- میانگین آنتالپی پیوند برای سادهسازی محاسبات استفاده میشود.
- از اختلاف مجموع آنتالپیهای شکستن و تشکیل، میتوان ΔH واکنش را بهدست آورد.