آنتالپی چیست؟ | تعریف ساده و علمی
آنتالپی (Enthalpy) با نماد H، معیاری برای بیان محتوای انرژی یک سیستم در فشار ثابت است. در واقع آنتالپی نشان میدهد که چه مقدار انرژی در یک ماده یا سیستم شیمیایی ذخیره شده و هنگام واکنش یا تغییر فاز آزاد یا جذب میشود.
فرمول کلی آنتالپی:
H = U + P × V
که در آن:
- H = آنتالپی
- U = انرژی درونی سیستم
- P = فشار
- V = حجم
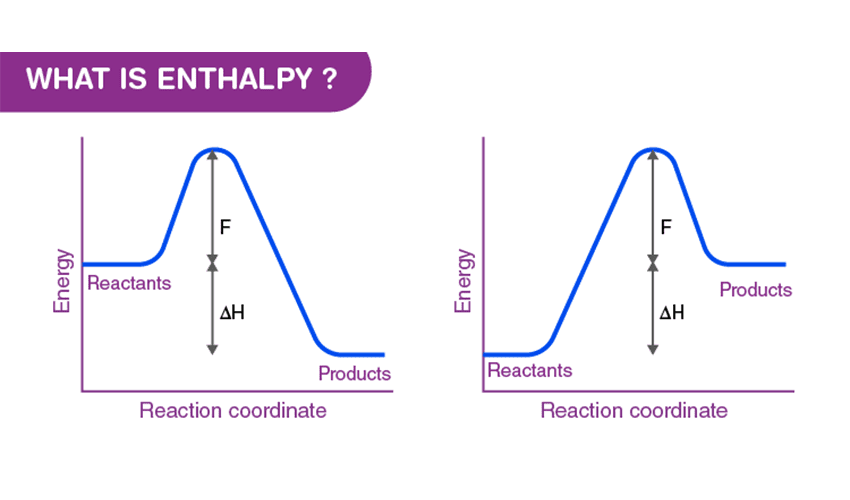
تغییرات آنتالپی در واکنشهای شیمیایی
در شیمی، مقدار تغییرات آنتالپی یا همان ΔH در طول یک واکنش بررسی میشود:
- اگر ΔH منفی باشد، واکنش گرماده است (انرژی آزاد میشود).
- اگر ΔH مثبت باشد، واکنش گرماگیر است (انرژی جذب میشود).
انواع آنتالپیهای مهم
| نوع آنتالپی | توضیح |
|---|---|
| آنتالپی تشکیل (ΔHf) | انرژی لازم برای تشکیل یک مول از ماده از عناصر پایه |
| آنتالپی سوختن (ΔHc) | انرژی آزاد شده هنگام سوختن یک مول ماده در حضور اکسیژن |
| آنتالپی خنثیسازی | انرژی آزاد شده هنگام واکنش اسید و باز برای تشکیل آب |
| آنتالپی تبخیر / ذوب | انرژی لازم برای تغییر فاز از مایع به بخار یا جامد به مایع |
کاربردهای آنتالپی در شیمی و صنعت
- پیشبینی گرماگیری یا گرمازایی واکنشها
- طراحی فرآیندهای صنعتی مانند احتراق و تولید مواد
- بررسی راندمان سیستمهای انرژی مثل موتور و پیل سوختی
- کنترل واکنشها در آزمایشگاهها و صنایع داروسازی
مثال ساده: واکنش گرماده در برابر واکنش گرماگیر
واکنش گرماده (مثلاً سوختن متان):
CH₄ + 2O₂ → CO₂ + 2H₂O ΔH = -890 kJ/mol
(انرژی آزاد شده و محیط گرم میشود)
واکنش گرماگیر (مثلاً تجزیه کلسیم کربنات):
CaCO₃ → CaO + CO₂ ΔH = +178 kJ/mol
(انرژی جذب شده و محیط سرد میشود)
جمعبندی
آنتالپی مفهومی مهم در شیمی و ترمودینامیک است که با آن میتوان رفتار انرژی در واکنشهای شیمیایی را درک کرد. بررسی تغییرات آنتالپی به ما کمک میکند تا بدانیم آیا واکنش انرژی آزاد میکند یا جذب، و آیا برای کاربردهای صنعتی یا آزمایشگاهی مناسب است یا نه.