مقدمه:
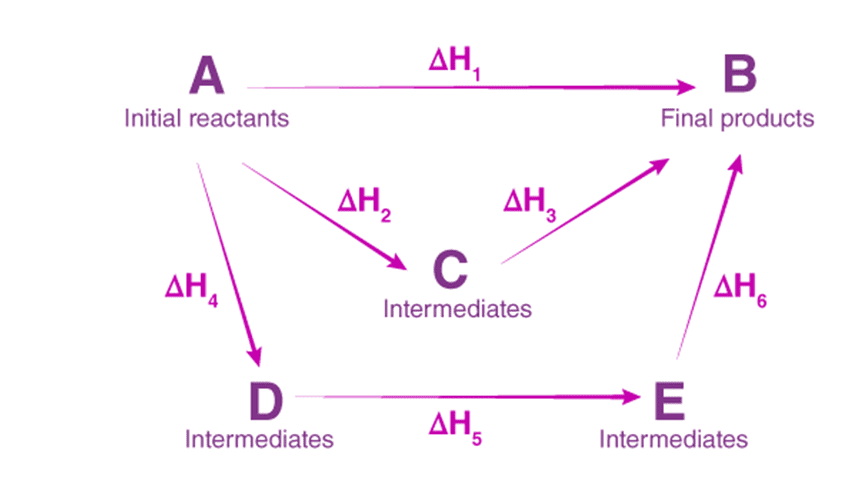
در شیمی ترمودینامیک، بسیاری از واکنشها را نمیتوان به طور مستقیم در آزمایشگاه انجام داد، اما میتوان گرمای آنها را با استفاده از قانونی به نام قانون هس محاسبه کرد. این قانون یکی از مهمترین ابزارهای شیمیدانان برای محاسبه آنتالپی واکنشهاست.
قانون هس چیست؟
قانون هس میگوید:
اگر یک واکنش شیمیایی را بتوان به چند مرحله تقسیم کرد، آنگاه مجموع گرماهای هر مرحله برابر با گرمای واکنش کلی است.
به بیان سادهتر، تغییر آنتالپی یک واکنش تنها به حالت ابتدایی و نهایی بستگی دارد، نه به مسیر انجام واکنش.
فرمول قانون هس:
اگر واکنش کلی A → D از دو مرحله زیر تشکیل شده باشد:
- A → B (آنتالپی: ΔH1)
- B → D (آنتالپی: ΔH2)
آنگاه:
ΔH_total = ΔH1 + ΔH2
مثال کاربردی از قانون هس:
فرض کنید میخواهیم آنتالپی واکنش زیر را به دست آوریم:
C(graphite) + 1/2 O2(g) → CO(g) → ΔH = ?
اما فقط اطلاعات مربوط به دو واکنش زیر را در اختیار داریم:
C(graphite) + O2(g) → CO2(g) ΔH = -393.5 kJ/mol
CO(g) + 1/2 O2(g) → CO2(g) ΔH = -283.0 kJ/mol
برای حل این مسئله، واکنش دوم را معکوس میکنیم:
CO2(g) → CO(g) + 1/2 O2(g) ΔH = +283.0 kJ/mol
حالا دو واکنش را با هم جمع میکنیم:
C(graphite) + O2(g) → CO2(g) ΔH = -393.5
CO2(g) → CO(g) + 1/2 O2(g) ΔH = +283.0
نتیجه:
C(graphite) + 1/2 O2(g) → CO(g) ΔH = -110.5 kJ/mol
کاربردهای قانون هس:
- محاسبه آنتالپی واکنشهایی که به صورت مستقیم قابل اندازهگیری نیستند
- بررسی انرژی در واکنشهای چندمرحلهای
- طراحی فرآیندهای صنعتی و سنتز داروها
- محاسبه انرژی پیوندها و انرژیهای تشکیل
نکات مهم هنگام استفاده از قانون هس:
- اگر یک واکنش را معکوس کردید، علامت ΔH نیز تغییر میکند.
- اگر ضرایب یک واکنش را دو برابر کردید، ΔH نیز دو برابر میشود.
- باید مواد مشترک در طرفین واکنشها را حذف کنید تا واکنش کلی به دست آید.
جمعبندی:
قانون هس به ما اجازه میدهد انرژی واکنشهایی را که بهطور مستقیم نمیتوان اندازه گرفت، به سادگی و با دقت بالا محاسبه کنیم. این قانون نشان میدهد که آنتالپی یک تابع حالت است و صرفنظر از مسیر واکنش، فقط به ابتدا و انتهای مسیر بستگی دارد. درک این قانون، گامی مهم در فهم عمیقتر شیمی انرژی است.