یونش و درجه یونش: مفاهیم پایه در رفتار شیمیایی اسیدها و بازها
مقدمه
برای درک بهتر رفتار اسیدها، بازها و نمکها در محلولهای آبی، باید با مفاهیم یونش (Ionization) و درجه یونش (Degree of Ionization) آشنا باشیم. این مفاهیم نقش کلیدی در تعیین قدرت اسیدی، رسانایی الکتریکی، و میزان واکنشپذیری مواد در محلول دارند.
یونش چیست؟
یونش فرآیندی است که در آن یک مولکول خنثی (مانند یک اسید یا باز) در آب به یونهای مثبت و منفی تجزیه میشود.
مثال ساده:
⁻HA + H₂O ⇌ H₃O⁺ + A
در این واکنش، HA یک اسید است که با آب واکنش داده و به یون هیدرونیوم (⁺H₃O) و آنیون ⁻A تبدیل میشود.
انواع یونش
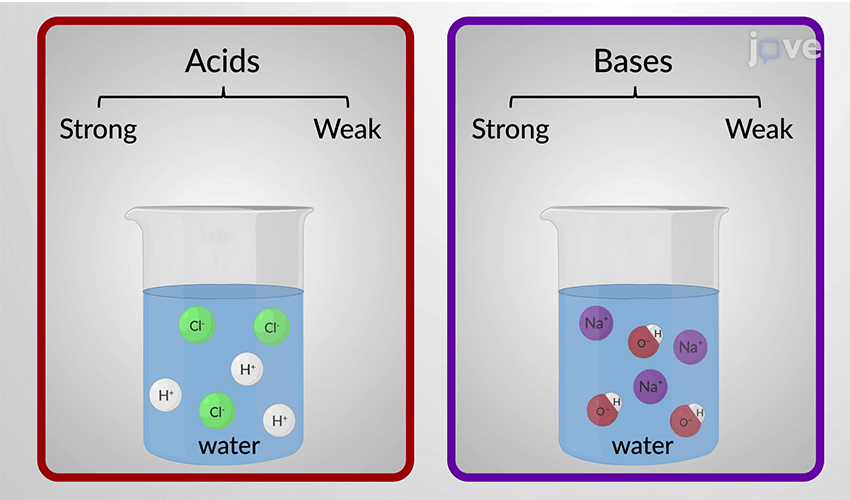
1. یونش کامل (کامل تفکیکشونده):
مواد بهطور کامل به یون تبدیل میشوند.
معمولاً در اسیدها و بازهای قوی دیده میشود.
مثال:
–HCl → H⁺ + Cl
2. یونش ناقص (جزئی):
فقط بخشی از مولکولها یونیزه میشوند.
در اسیدها و بازهای ضعیف اتفاق میافتد.
مثال:
⁻CH₃COOH ⇌ H⁺ + CH₃COO
درجه یونش چیست؟
درجه یونش یا درصد یونش (Degree of Ionization) مقدار نسبی مولکولهایی است که در محلول به یون تبدیل شدهاند.
فرمول درجه یونش:
α = (تعداد مولکولهای یونیزهشده) / (تعداد کل مولکولها)
یا در حالت درصد:
درصد یونش = (مولهای یونیزهشده / مول کل) × 100
عوامل مؤثر بر درجه یونش
1. نوع ماده:
اسید یا باز قوی → درجه یونش بالا
اسید یا باز ضعیف → درجه یونش پایین
2. غلظت محلول:
در غلظتهای رقیق، درجه یونش بیشتر است (اصل لوشاتلیه)
3. دما:
معمولاً افزایش دما باعث افزایش یونش میشود.
4.حضور یون مشترک:
وجود یونهای مشابه در محلول میتواند یونش را کاهش دهد (اثر یون مشترک).
مثال عددی از محاسبه درجه یونش
اگر از یک اسید ضعیف، محلولی ۰/۱ مولار تهیه کنیم و فقط ۰/۰۰۱ مول آن یونیزه شود، درجه یونش چنین محاسبه میشود:
α = 0.001 / 0.1 = 0.01 → 1%
یعنی تنها یک درصد از مولکولها یونیزه شدهاند.
کاربرد درجه یونش در شیمی
تشخیص قدرت اسید و باز
پیشبینی رسانایی الکتریکی محلول
محاسبه pH و غلظت یونها
تحلیل تعادلهای یونی در واکنشها
ارتباط با ثابت تفکیک (Ka)
در اسیدهای ضعیف، میتوان درجه یونش را با ثابت تفکیک یون (Ka) مرتبط دانست:
Ka = [H⁺]² / [HA]₀
با دانستن Ka و غلظت اولیه، میتوان α را تقریب زد:
α ≈ √(Ka / [HA]₀)
نتیجهگیری
یونش و درجه یونش ابزارهای اساسی برای تحلیل واکنشهای شیمیایی در محلولهای آبی هستند. با درک این مفاهیم میتوان رفتار اسیدها، بازها و نمکها را در واکنشها بهطور دقیقتری پیشبینی کرد.