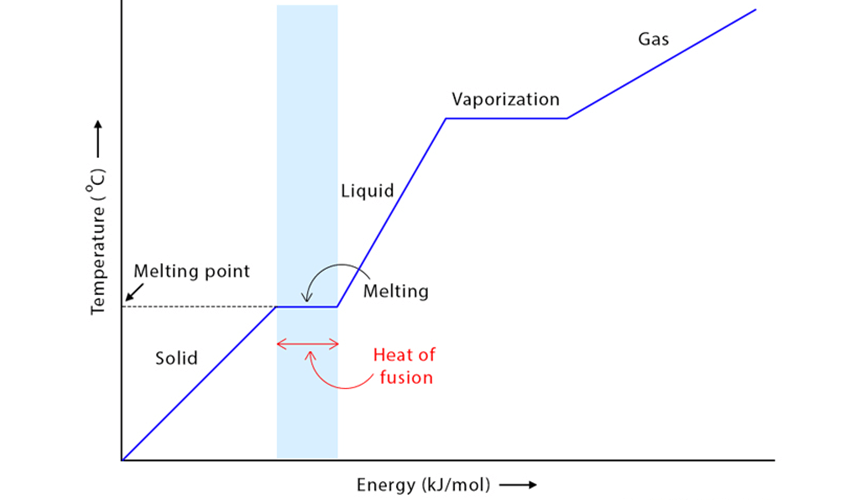
تعریف آنتالپی ذوب
آنتالپی ذوب (Enthalpy of Fusion) به مقدار گرمایی گفته میشود که باید به یک مول از ماده جامد داده شود تا در دمای ذوب خود، به مایع تبدیل شود؛ بدون اینکه دما تغییر کند. این انرژی صرف شکستن بخشی از پیوندهای بین مولکولی یا بین اتمی در ساختار جامد میشود.
نماد و واحدها
این کمیت معمولاً با نماد زیر نشان داده میشود:
ΔHfus یا ΔHf
و رایجترین واحدهای آن عبارتند از:
- کیلوژول بر مول (kJ/mol)
- ژول بر گرم (J/g) برای دادههای آزمایشگاهی
مثال ساده برای درک بهتر
برای ذوب شدن 1 مول یخ (آب جامد) در دمای صفر درجه سلسیوس، حدود 6.01 کیلوژول انرژی مورد نیاز است. یعنی برای تبدیل 18 گرم یخ به آب، بدون تغییر دما، باید 6.01 kJ گرما به آن داده شود.
تفاوت آنتالپی ذوب با سایر تغییر فازها
| نوع آنتالپی | تغییر فاز | مقدار انرژی نسبی |
|---|---|---|
| آنتالپی ذوب (ΔHfus) | جامد → مایع | نسبتاً کم (شکستن بخشی از پیوندها) |
| آنتالپی تبخیر (ΔHvap) | مایع → گاز | زیاد (شکستن کامل پیوندهای بینمولکولی) |
| آنتالپی تصعید (ΔHsub) | جامد → گاز | مجموع دو مورد بالا |
فرمول ساده برای محاسبه آنتالپی ذوب
اگر مقدار انرژی و جرم ماده را داشته باشیم، میتوان از فرمول زیر استفاده کرد:
ΔHfus = q / n
که در آن:
- q: گرمای جذبشده (کیلوژول)
- n: تعداد مول ماده
- ΔHfus: آنتالپی ذوب بر حسب kJ/mol
عوامل مؤثر بر آنتالپی ذوب
- نوع ماده
مواد یونی و فلزی معمولاً آنتالپی ذوب بالاتری دارند نسبت به ترکیبات مولکولی ساده. - استحکام شبکه جامد
هرچه ساختار بلوری محکمتر باشد، انرژی بیشتری برای ذوب آن نیاز است. - وجود ناخالصیها
ناخالصیها معمولاً نقطه ذوب را کاهش میدهند و ممکن است بر مقدار انرژی لازم نیز اثر بگذارند.
کاربردهای آنتالپی ذوب
- در صنعت ریختهگری و متالورژی برای ذوب فلزات
- در داروسازی برای شناسایی خلوص مواد
- در طراحی فرآیندهای گرمایی و سرمایشی
- در مطالعات اقلیمشناسی برای تحلیل تغییرات یخ در قطبها
نتیجهگیری
آنتالپی ذوب، کلید ورود جامدات به دنیای مایع است. این ویژگی فیزیکی نهتنها در مباحث نظری، بلکه در کاربردهای عملیِ متنوعی مانند ساخت قطعات صنعتی، بررسی ترکیبات دارویی، و تحلیلهای زیستمحیطی، اهمیت دارد. شناخت و استفاده صحیح از این کمیت، دید عمیقتری از رفتار ماده به ما میدهد.