تعریف آنتالپی تصعید
آنتالپی تصعید (Enthalpy of Sublimation) مقدار گرمایی است که باید به یک مول از ماده جامد داده شود تا به بخار تبدیل شود، بدون اینکه ابتدا به مایع تبدیل گردد. این فرایند تغییر فاز مستقیم از حالت جامد به گاز است که در برخی مواد، مانند ید یا دیاکسید کربن خشک، بهصورت طبیعی دیده میشود.
نماد و واحدها
آنتالپی تصعید معمولاً با نماد زیر نشان داده میشود:
ΔHsub یا ΔHsubl
و واحد رایج آن:
- کیلوژول بر مول (kJ/mol)
- یا ژول بر گرم (J/g) در موارد خاص آزمایشگاهی
مثال کاربردی برای درک بهتر
تصعید ید یکی از شناختهشدهترین نمونههاست. وقتی بلورهای ید را گرم میکنیم، مستقیماً از حالت جامد به بخار بنفشرنگ تبدیل میشوند، بدون اینکه ذوب شوند. برای هر 1 مول ید، حدود 62 کیلوژول انرژی نیاز است تا این تغییر فاز رخ دهد.
تفاوت آنتالپی تصعید با سایر آنتالپیها
| نوع آنتالپی | نوع تغییر فاز | ویژگی اصلی |
|---|---|---|
| آنتالپی ذوب (ΔHfus) | جامد → مایع | نیاز به غلبه بر بخشی از نیروهای بینمولکولی |
| آنتالپی تبخیر (ΔHvap) | مایع → گاز | شکستن کاملتر پیوندهای بینمولکولی |
| آنتالپی تصعید (ΔHsub) | جامد → گاز | شکستن کامل نیروهای بینمولکولی، بدون عبور از فاز مایع |
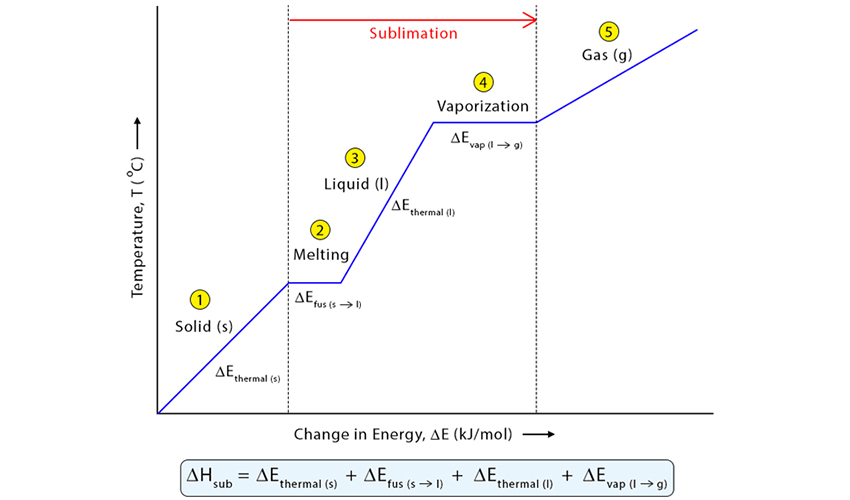
رابطه مهم آنتالپی تصعید
در بسیاری از منابع ترمودینامیکی، آنتالپی تصعید بهصورت مجموع آنتالپی ذوب و تبخیر نیز تعریف میشود:
ΔHsub = ΔHfus + ΔHvap
✅ این رابطه فقط در شرایطی معتبر است که ماده ابتدا ذوب و سپس تبخیر شود.
عوامل مؤثر بر آنتالپی تصعید
- ساختار کریستالی ماده جامد
هرچه نیروهای بین مولکولی در شبکه جامد قویتر باشند، انرژی بیشتری برای تصعید نیاز است. - دمای تصعید
مقدار انرژی مورد نیاز به دما نیز وابسته است. با افزایش دما، برخی مواد راحتتر تصعید میشوند. - فشار بخار جامد
موادی با فشار بخار بالا در دمای اتاق (مثل ید یا نفتالین) مستعد تصعید هستند.
کاربردهای آنتالپی تصعید
- خشککردن انجمادی (Freeze Drying)
- تهیه و تصفیه مواد حساس به حرارت
- شناسایی خواص ترمودینامیکی مواد جامد
- درک رفتار فضایی دنبالهدارها، برف خشک و سایر پدیدههای نجومی
نتیجهگیری
آنتالپی تصعید یکی از مفاهیم کلیدی در شیمی فیزیک و ترمودینامیک است که نشان میدهد برای تبدیل یک جامد مستقیماً به بخار، چه مقدار انرژی نیاز است. این ویژگی در طراحی دستگاههای صنعتی، داروسازی، و حتی در مطالعات علمیِ منظومه شمسی کاربرد دارد و درک آن به فهم بهتر رفتار مواد در دماها و فشارهای مختلف کمک میکند.