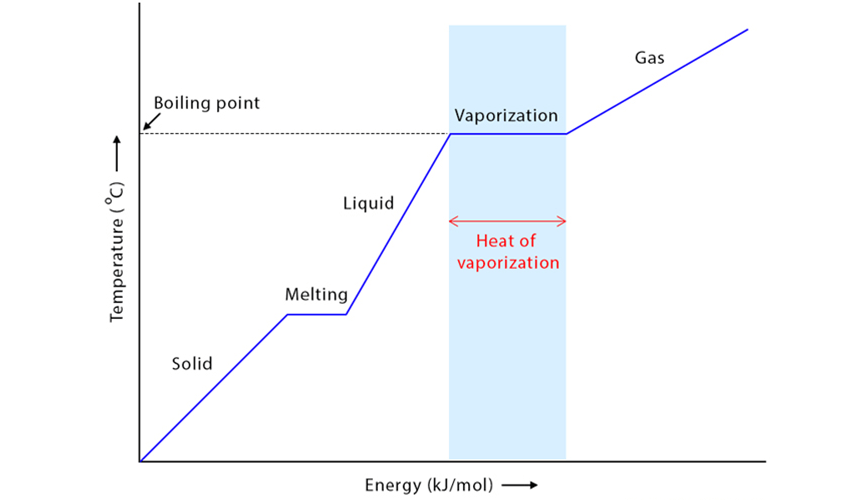
تعریف آنتالپی تبخیر
آنتالپی تبخیر (Enthalpy of Vaporization)، مقدار گرمایی است که باید به یک واحد جرم یا مول از مایع داده شود تا بدون تغییر دما، به بخار تبدیل شود. این مقدار انرژی برای غلبه بر نیروهای بین مولکولی در فاز مایع و انتقال مولکولها به فاز گازی لازم است.
نماد و واحدها
آنتالپی تبخیر معمولاً با نماد ΔHvap\Delta H_{vap} یا ΔHv\Delta H_{v} نشان داده میشود و واحد آن بسته به نوع بیان، میتواند یکی از موارد زیر باشد:
- ژول بر گرم (J/g)
- کیلوژول بر مول (kJ/mol)
- کالری بر گرم (cal/g)
مثال ساده برای درک بهتر
در دمای 100 درجه سلسیوس، برای تبخیر 1 مول آب به بخار، تقریباً 40.7 کیلوژول انرژی نیاز است.
این عدد یعنی برای تبدیل 18 گرم آب در دمای جوش، به بخار در همان دما، باید 40.7 kJ گرما به سیستم وارد شود.
تفاوت آنتالپی تبخیر و نقطه جوش
گرچه هر دو به بخار شدن مربوط هستند، اما تفاوت اساسی دارند:
- نقطه جوش: دمایی که فشار بخار مایع برابر با فشار محیط میشود.
- آنتالپی تبخیر: مقدار گرمای مورد نیاز برای تغییر فاز از مایع به گاز در نقطه جوش.
عوامل مؤثر بر آنتالپی تبخیر
- نوع ماده و نیروهای بینمولکولی
هرچه نیروهای بینمولکولی (مثل پیوند هیدروژنی در آب) قویتر باشند، آنتالپی تبخیر نیز بیشتر خواهد بود. - فشار محیط
آنتالپی تبخیر معمولاً در فشار استاندارد (1 atm) اندازهگیری میشود، اما با تغییر فشار، تغییراتی نیز در آن ایجاد میشود. - دمای تبخیر
اگرچه در محاسبات استاندارد دما ثابت است، اما در شرایط واقعی، تغییر دما میتواند بر انرژی مورد نیاز تأثیر بگذارد.
فرمول محاسبه ساده آنتالپی تبخیر
اگر مقدار ماده و انرژی تبخیر دادهشده را داشته باشیم، میتوان گفت:
ΔHvap = q / n
که در آن:
- q: انرژی وارد شده (kJ)
- n: تعداد مول ماده تبخیر شده
- ΔHvap: آنتالپی تبخیر بر حسب kJ/mol
کاربردهای آنتالپی تبخیر در دنیای واقعی
- سیستمهای تبرید و تهویه مطبوع
- صنعت تقطیر (مانند تصفیه نفت یا الکل)
- مدلسازی تبخیر آب از سطح دریاچهها یا خاک
- درک فرآیندهای زیستی مانند تعریق و خنکسازی بدن
اهمیت در آموزش و پژوهش
آنتالپی تبخیر یکی از مفاهیم پایهای در درس ترمودینامیک و شیمی فیزیک است و به درک بهتر پدیدههایی مانند جوشش، تعریق، مه و میعان کمک میکند. همچنین، دانستن آن در طراحی دستگاههایی مانند دیگ بخار یا سیستمهای خنککننده بسیار حیاتی است.
نتیجهگیری
آنتالپی تبخیر یکی از مهمترین ویژگیهای فیزیکی مایعات است که دانستن آن نهتنها در مسائل نظری بلکه در فرآیندهای صنعتی و طبیعی کاربرد دارد. این مفهوم به ما نشان میدهد که برای شکستن پیوندهای مولکولی در فاز مایع و انتقال ماده به حالت گازی، چه میزان انرژی لازم است — و همین موضوع یکی از کلیدهای فهم رفتار ماده در شرایط مختلف است.